Ostéopathies fragilisantes
![]() La définition de l'ostéoporose de l'OMS est la suivante :
La définition de l'ostéoporose de l'OMS est la suivante :
« L'ostéoporose est une maladie généralisée du squelette, caractérisée par une résistance osseuse diminuée prédisposant à un risque élevé de fracture. La résistance osseuse est la résultante de la densité osseuse et de la qualité osseuse (altération de la microarchitecture osseuse notamment). »
Un épisode fracturaire est la complication de la maladie ostéoporotique et constitue toute la gravité de cette maladie. En pratique, toute fracture survenant après un traumatisme à bas niveau d'énergie (comme une chute de sa hauteur) et après l'âge de 50 ans doit faire évoquer une ostéoporose (sauf en cas de fracture du crâne, de la face, du rachis cervical, des trois premières vertèbres thoraciques, des doigts et des orteils).
Certaines fractures dites sévères sont associées à un excès de mortalité, notamment :
L'excès précoce de mortalité suivant la survenue d'une FESF est plus important chez l'homme que chez la femme, traduisant la grande fragilité des hommes victimes de ces fractures. En effet, 1 femme sur 5 et 1 homme sur 3 vont décéder dans l'année qui suit une FESF.
À côté de ces fractures sévères, il existe d'autres fractures dites « non sévères » (poignet et autres fractures).
On définit également le terme de fractures majeures pour les quatre sites ayant la plus grande incidence : FESF, FESH, poignet et fracture vertébrale clinique (c'est-à-dire révélée par un syndrome rachidien douloureux).
![]() Après 50 ans, 1 femme sur 2 et 1 homme sur 5 auront une fracture ostéoporotique au cours de leur vie, ce qui témoigne de la fréquence de cette maladie.
Après 50 ans, 1 femme sur 2 et 1 homme sur 5 auront une fracture ostéoporotique au cours de leur vie, ce qui témoigne de la fréquence de cette maladie.
L‘incidence des fractures augmente de façon exponentielle à partir de 50 ans.
En France, il survient chaque année :
À noter que les fractures du poignet ne sont pas toujours de nature ostéoporotique. Les données récentes montrent que le nombre de patients opérés pour FESF continue d'augmenter chez les femmes et surtout chez les hommes en raison du vieillissement de la population.
L'ostéoporose rentre dans le cadre des maladies chroniques dépendant de phénomènes de sénescence stimulés par les agressions environnementales et un état subinflammatoire. Le déficit œstrogénique chez la femme vient se potentialiser avec ces mécanismes et accélérer la perte osseuse conduisant à une ostéoporose dite post-ménopausique.
L'ostéoporose peut également être induite par d'autres pathologies ou par des traitements. Ces ostéoporoses dites secondaires sont plus fréquentes chez l'homme (> 50 % des cas). Bien entendu, les causes peuvent être intriquées.
Le squelette est composé d'os cortical (majoritaire dans la diaphyse des os longs) et d'os trabéculaire (majoritaire dans les vertèbres).
Le tissu osseux a plusieurs fonctions :
Il existe un remaniement constant de ce tissu (remodelage osseux), beaucoup plus rapide dans l'os trabéculaire. Le remodelage osseux comporte schématiquement :
Chez le jeune adulte, il existe un équilibre permettant d'adapter la formation à la résorption ; ceci aboutit au renouvellement et à la réparation du tissu osseux.
Une perte osseuse peut être la conséquence d'une augmentation de la résorption comme durant la ménopause ou d'une diminution de la formation comme durant la prise de corticothérapie.
![]() L'ostéoporose est une maladie silencieuse.
L'ostéoporose est une maladie silencieuse.
Le diagnostic doit être évoqué :
La survenue de fractures fait toute la gravité de la maladie ostéoporotique ![]() .
.
Les fractures ostéoporotiques sont classées dans le groupe des fractures par insuffisance osseuse. En effet, on distingue classiquement trois groupes de fractures :
Toute fracture survenant en dehors d'un traumatisme violent, c'est-à-dire pour une énergie correspondant à une simple chute de sa hauteur, doit faire évoquer le diagnostic d'ostéoporose (sauf les fractures du crâne, du rachis cervical, des trois premières vertèbres thoraciques, des doigts et des orteils).
Les plus fréquentes des fractures ostéoporotiques sont la fracture du poignet survenant dès 50 ans, la fracture vertébrale survenant dès 65 ans et la FESF survenant dès 70 ans. Ainsi, la fracture du poignet doit être considérée comme un signal d'alarme conduisant à la recherche de facteurs de risque d'ostéoporose et à la réalisation d'une DMO. Attention, toutes les fractures du poignet ne sont pas ostéoporotiques ! Ces fractures emblématiques ne doivent pas faire oublier les autres fractures périphériques qui peuvent également révéler une fragilité osseuse et qui sont trop souvent négligées : humérus, côtes, bassin, tibia…
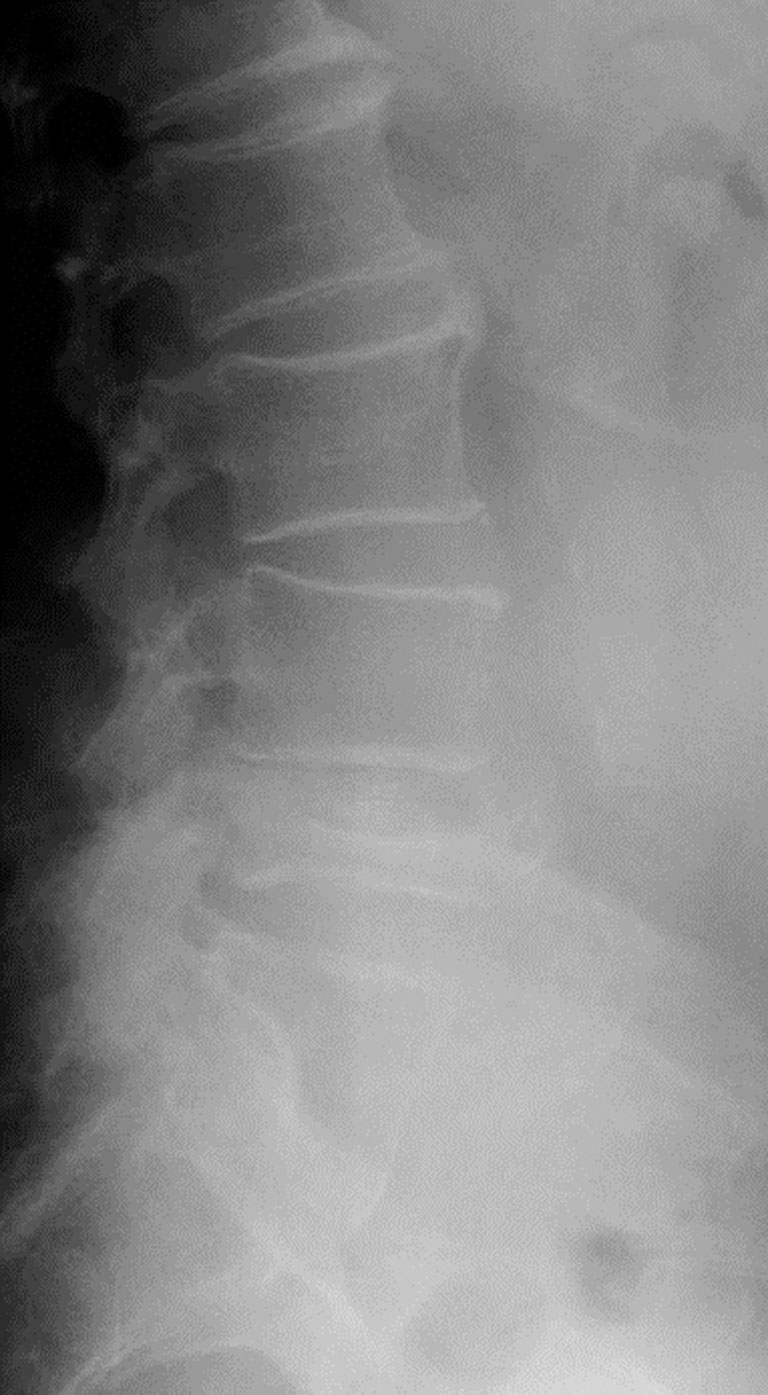
La fracture vertébrale ostéoporotique (fig. 7.1) n'est pas toujours symptomatique. Lorsqu'elle l'est, elle se traduit par des rachialgies aiguës d'horaire mécanique et une impotence fonctionnelle souvent sévère. La douleur s'estompe habituellement en 4 à 6 semaines. L'état général du patient est conservé et l'examen neurologique est dans l'immense majorité des cas normal (respect du mur postérieur). Environ deux tiers des fractures vertébrales ne sont pas portées à la connaissance médicale lors de l'épisode fracturaire. En pratique, il est recommandé de pratiquer des radiographies à la recherche de fracture(s) vertébrale(s) en cas de perte de taille significative (≥ 4 cm par rapport à une taille déclarée). Il est donc fondamental de mesurer les patients. En effet, la mise en évidence d'une fracture vertébrale ostéoporotique modifie la prise en charge des patients.
Fig. 7-1 :![]() Radiographie du rachis lombaire de profil. Fracture vertébrale de L4 en « galette ».
Radiographie du rachis lombaire de profil. Fracture vertébrale de L4 en « galette ».
L'ostéoporose correspond à une fragilité osseuse et les études biomécaniques montrent que la densité minérale osseuse (DMO) est le déterminant principal de la fragilité osseuse.
L'absorptiométrie biphotonique aux rayons X (DXA) est la technique de référence pour la mesure de la DMO ![]() .
.
Elle mesure la densité surfacique du tissu minéralisé (et ne permet donc pas de préjuger de la cause d'une densité basse).
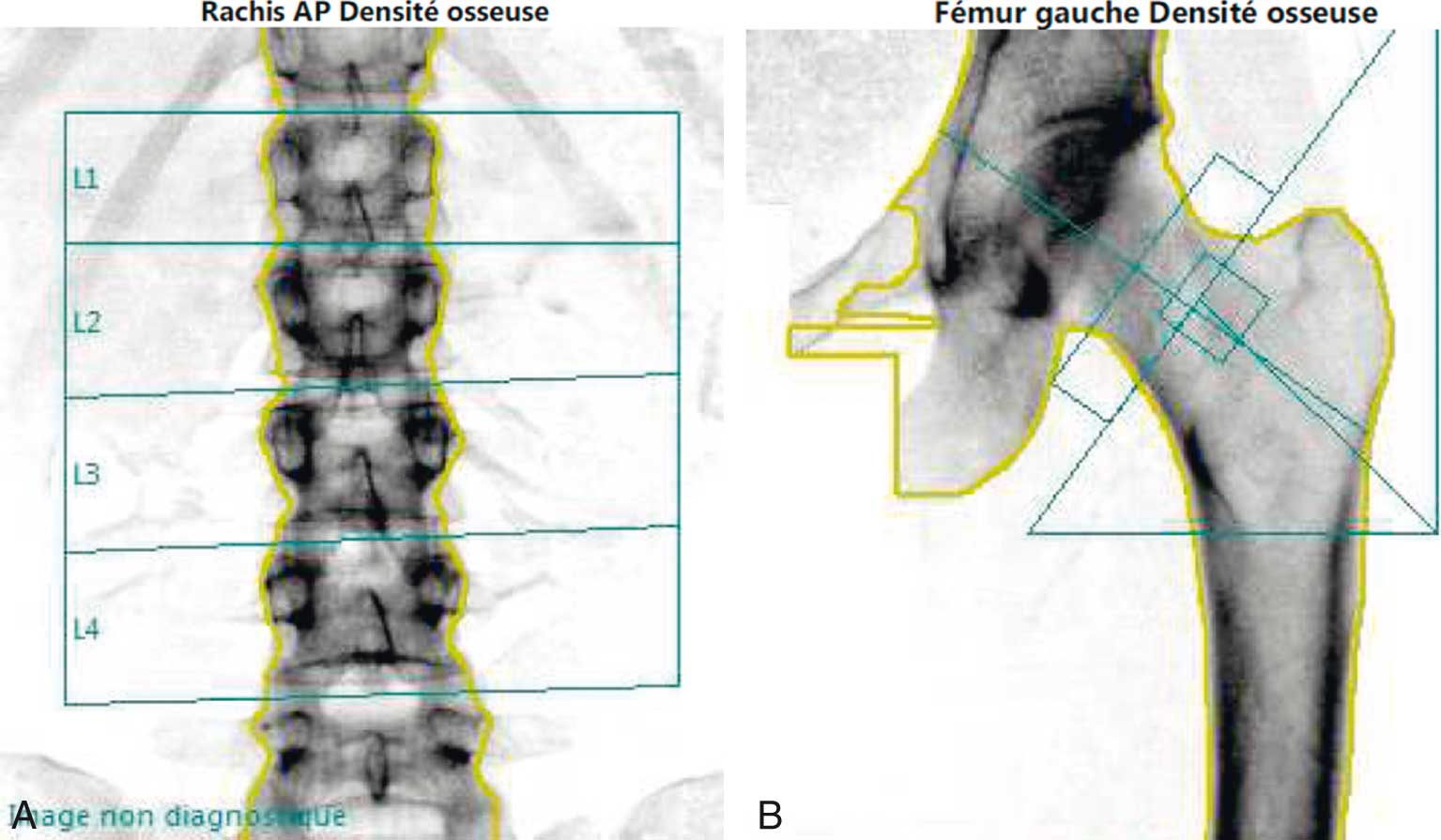
Les caractéristiques de la DXA (fig. 7.2) sont :
Fig. 7-2 :![]() Mesure de la densité minérale osseuse : images de DXA (rachis lombaire et extrémité supérieure du fémur).
Mesure de la densité minérale osseuse : images de DXA (rachis lombaire et extrémité supérieure du fémur).
Lors de la survenue d'une fracture d'allure ostéoporotique (ou sa découverte sur des radiographies) ou devant la découverte par l'interrogatoire d'un ou plusieurs facteurs de risque d'ostéoporose, la réalisation d'une DMO est nécessaire (encadré 7.1).
Encadré 7.1 : Indications d'ostéodensitométrie reconnues et remboursées par l'assurance maladie (à titre indicatif)
Évolution de la DMO au cours de la vie
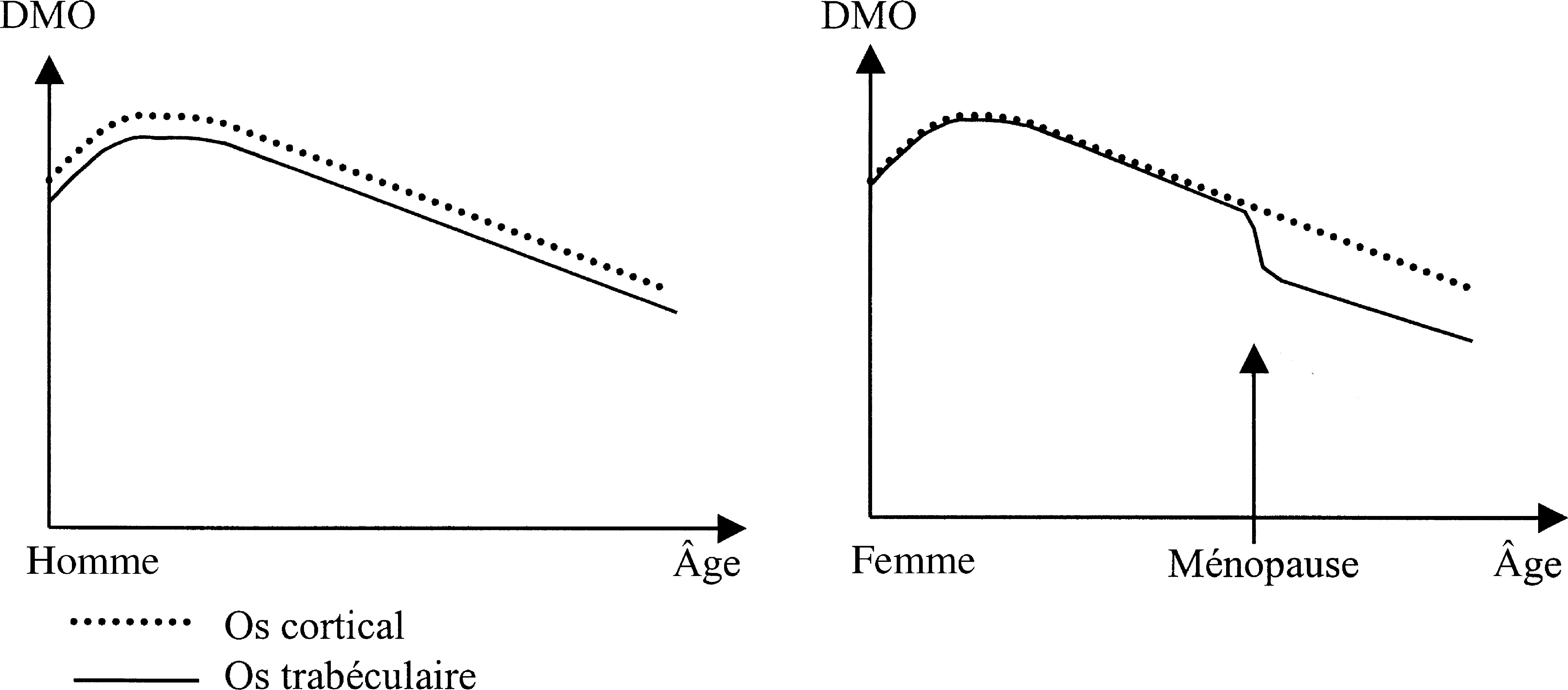
La figure 7.3 montre l'évolution de la DMO lombaire au cours de la vie chez la femme et chez l'homme.Fig. 7-3 :![]() Évolution de la densité minérale osseuse chez l'homme et la femme en fonction de l'âge.
Évolution de la densité minérale osseuse chez l'homme et la femme en fonction de l'âge.
Comme cela a été souligné précédemment, la diminution de la DMO est le déterminant principal du risque de fracture ostéoporotique ![]() . Les études épidémiologiques montrent qu'une diminution d'un écart-type de la DMO par rapport à la moyenne pour l'âge multiplie par deux le risque de fracture.
. Les études épidémiologiques montrent qu'une diminution d'un écart-type de la DMO par rapport à la moyenne pour l'âge multiplie par deux le risque de fracture.
L'autre facteur clé est la survenue de chutes, particulièrement chez les personnes âgées. Pour le clinicien, un certain nombre de facteurs de risque cliniques essentiels pour l'évaluation du risque fracturaire doivent être pris en compte ![]() :
:
En pratique, la décision thérapeutique est guidée par une évaluation du risque individuel de fracture ostéoporotique ![]() . Ce risque repose sur la prise en compte des facteurs de risque de fracture suivants.
. Ce risque repose sur la prise en compte des facteurs de risque de fracture suivants.
Facteurs de risque de fracture
* Facteurs de risque de fracture ostéoporotique partiellement indépendant de la DMO.
La corticothérapie, quel qu'en soit le motif, est à l'origine d'une perte osseuse dont l'intensité dépend de la dose reçue et de la durée du traitement, pouvant conduire à la survenue de fractures avec un niveau de DMO plus élevé que dans l'ostéoporose post-ménopausique.
Les principales causes médicamenteuses d'ostéoporose sont : corticoïdes, anti-aromatases (cancer du sein) et anti-androgènes (cancer de la prostate).
La recherche d'une cause d'ostéoporose secondaire est importante ![]() , tout particulièrement chez l'homme mais pas seulement : corticothérapie, hypogonadisme, hyperparathyroïdie primaire, consommation alcoolique excessive (≥ 3 unités par jour), tabagisme, hémochromatose génétique, maladies de l'appareil digestif (gastrectomie, résections intestinales étendues, entérocolopathies inflammatoires, syndromes de malabsorption, maladie cœliaque…), maladies inflammatoires chroniques en dehors de toute corticothérapie (polyarthrite rhumatoïde, spondyloarthrites…), hyperthyroïdie, anorexie mentale…
, tout particulièrement chez l'homme mais pas seulement : corticothérapie, hypogonadisme, hyperparathyroïdie primaire, consommation alcoolique excessive (≥ 3 unités par jour), tabagisme, hémochromatose génétique, maladies de l'appareil digestif (gastrectomie, résections intestinales étendues, entérocolopathies inflammatoires, syndromes de malabsorption, maladie cœliaque…), maladies inflammatoires chroniques en dehors de toute corticothérapie (polyarthrite rhumatoïde, spondyloarthrites…), hyperthyroïdie, anorexie mentale…![]() Le score FRAX® est un outil proposé par l'OMS qui permet de quantifier (en %) le risque de fractures majeures (FESF, humérus, poignets et fractures vertébrales cliniques) et de FESF dans les 10 ans et qui a été validé chez les femmes ménopausées et chez les hommes de plus de 40 ans. Le calcul du FRAX® n'est pas utile chez les patients dont l'indication de traiter est évidente. Le calcul du FRAX® est une combinaison de facteurs de risque d'ostéoporose associés ou pas avec la DMO au col fémoral. Le seuil d'intervention thérapeutique dans l'ostéoporose post-ménopausique et masculine dépend de la valeur du FRAX® calculée pour les fractures majeures et de l'âge. Le calcul du FRAX® peut être réalisé directement à partir du site internet du FRAX®.
Le score FRAX® est un outil proposé par l'OMS qui permet de quantifier (en %) le risque de fractures majeures (FESF, humérus, poignets et fractures vertébrales cliniques) et de FESF dans les 10 ans et qui a été validé chez les femmes ménopausées et chez les hommes de plus de 40 ans. Le calcul du FRAX® n'est pas utile chez les patients dont l'indication de traiter est évidente. Le calcul du FRAX® est une combinaison de facteurs de risque d'ostéoporose associés ou pas avec la DMO au col fémoral. Le seuil d'intervention thérapeutique dans l'ostéoporose post-ménopausique et masculine dépend de la valeur du FRAX® calculée pour les fractures majeures et de l'âge. Le calcul du FRAX® peut être réalisé directement à partir du site internet du FRAX®.
![]() Elles sont essentielles. Elles ont pour objectif d'affirmer la nature ostéoporotique de la fracture, de mettre éventuellement en évidence une cause d'ostéoporose secondaire et surtout d'éliminer les autres causes de fragilité osseuse
Elles sont essentielles. Elles ont pour objectif d'affirmer la nature ostéoporotique de la fracture, de mettre éventuellement en évidence une cause d'ostéoporose secondaire et surtout d'éliminer les autres causes de fragilité osseuse ![]() dont la prise en charge est différente (cf. § IV.E).
dont la prise en charge est différente (cf. § IV.E).
![]() Les radiographies standards de la fracture montrent l'existence d'une déminéralisation homogène sans signe d'ostéolyse.
Les radiographies standards de la fracture montrent l'existence d'une déminéralisation homogène sans signe d'ostéolyse.
En pratique, l'évaluation morphologique du rachis (par des radiographies le plus souvent) est indiquée s'il existe des rachialgies et/ou une perte de taille ≥ 4 cm. Il faut savoir « traquer » la fracture vertébrale au cours du bilan de l'ostéoporose.
Au rachis, plusieurs arguments plaident en faveur de la nature ostéoporotique d'une fracture vertébrale :
Cependant, aucun de ces signes n'est totalement spécifique. En cas de doute, la réalisation d'un scanner et/ou d'une IRM permettra de confirmer l'absence de signes évocateurs d'une autre origine, en particulier tumorale.
![]() Il n'y a pas de consensus sur les examens initiaux à effectuer systématiquement. On peut proposer de doser initialement :
Il n'y a pas de consensus sur les examens initiaux à effectuer systématiquement. On peut proposer de doser initialement :
Ces dosages ont pour but d'éliminer un diagnostic différentiel : une ostéopathie maligne (myélome ou métastases) ou une fragilité osseuse bénigne non ostéoporotique.
Au cours de l'ostéoporose, ces examens sont le plus souvent normaux. En effet, la calcémie et la phosphatémie sont normales dans l'ostéoporose.![]() À l'issue de ce bilan, il est exceptionnellement nécessaire de recourir à la biopsie osseuse avec double marquage à la tétracycline. Celle-ci reste indiquée dans des cas rares chez des gens jeunes par exemple en cas d'ostéoporose fracturaire avec une DMO peu abaissée, en l'absence de cause retrouvée, lors d'altérations complexes du métabolisme osseux chez des insuffisants rénaux.
À l'issue de ce bilan, il est exceptionnellement nécessaire de recourir à la biopsie osseuse avec double marquage à la tétracycline. Celle-ci reste indiquée dans des cas rares chez des gens jeunes par exemple en cas d'ostéoporose fracturaire avec une DMO peu abaissée, en l'absence de cause retrouvée, lors d'altérations complexes du métabolisme osseux chez des insuffisants rénaux.
![]() Devant une fracture d'allure ostéoporotique ou lors de la découverte d'une ostéoporose densitométrique, le diagnostic d'ostéoporose ne peut être retenu qu'après avoir éliminé :
Devant une fracture d'allure ostéoporotique ou lors de la découverte d'une ostéoporose densitométrique, le diagnostic d'ostéoporose ne peut être retenu qu'après avoir éliminé :
En effet, ces affections peuvent se manifester par une diminution de la DMO mais leur prise en charge est évidemment différente.
Toute atypie dans la présentation clinique ou toute anomalie dans les explorations complémentaires initiales, doit faire reconsidérer le diagnostic d'ostéoporose :
![]() Dans un deuxième temps, en fonction des données de l'examen clinique et des premiers résultats, des dosages biologiques permettent d'identifier une cause secondaire d'ostéoporose :
Dans un deuxième temps, en fonction des données de l'examen clinique et des premiers résultats, des dosages biologiques permettent d'identifier une cause secondaire d'ostéoporose :
![]() Quel que soit l'âge du patient et quel que soit l'objectif poursuivi (prévention de l'ostéoporose ou traitement d'une ostéoporose avérée), les mesures hygiéno-diététiques suivantes doivent toujours être mises en œuvre
Quel que soit l'âge du patient et quel que soit l'objectif poursuivi (prévention de l'ostéoporose ou traitement d'une ostéoporose avérée), les mesures hygiéno-diététiques suivantes doivent toujours être mises en œuvre ![]() :
:
Médicaments freinant la résorption osseuse Traitement hormonal de la ménopause Raloxifène Bisphosphonates![]() Les traitements antiostéoporotiques freinent la résorption osseuse ou stimulent la formation osseuse. Ils diminuent le risque de fracture vertébrale d'environ 40 à 70 % (en fonction des médicaments et de la gravité de l'ostéoporose) et le risque de fracture périphérique de 30 à 40 % (environ 50 % pour le risque des FESF).
Les traitements antiostéoporotiques freinent la résorption osseuse ou stimulent la formation osseuse. Ils diminuent le risque de fracture vertébrale d'environ 40 à 70 % (en fonction des médicaments et de la gravité de l'ostéoporose) et le risque de fracture périphérique de 30 à 40 % (environ 50 % pour le risque des FESF).
Les bisphosphonates oraux comprennent :
L'alendronate est contre-indiqué en cas d'antécédent d'œsophagite. Ils nécessitent que les règles d'administration soient scrupuleusement respectées ; particulièrement la prise le matin à jeun avec un grand verre d'eau du robinet en dehors de toute prise alimentaire, médicamenteuse ou calcique sous peine que le médicament ne soit pas absorbé. Une nouvelle formulation du risédronate dite gastrorésistante permet une prise à l'issue de la prise alimentaire. Les patients ne doivent pas se coucher dans les 30 minutes suivant la prise pour éviter les effets secondaires œsophagiens.
L'acide zolédronique (5 mg) est également un bisphosphonate administré par voie intraveineuse une fois par an.
Tous les bisphosphonates augmentent le risque d'ostéonécrose de la mâchoire même si l'incidence de cet événement indésirable est très faible (environ 1 pour 10 000 par an) lorsqu'ils sont utilisés aux doses antiostéoporotiques. Les patients sous bisphosphonates doivent comme dans la population générale avoir un suivi régulier chez leur dentiste pour traiter les foyers infectieux dentaires chroniques, facteurs favorisants d'ostéonécrose de la mâchoire sous bisphosphonates.
Dénosumab
Le dénosumab est une biothérapie ciblant le RANKL (anticorps monoclonal anti-RANKL) ayant une action inhibitrice de la résorption osseuse. Il augmente durablement la DMO et diminue l'incidence des fractures vertébrales et périphériques dont la FESF. Il s'administre par voie sous-cutanée (à la posologie de 60 mg) tous les 6 mois. Il est remboursé dans l'ostéoporose post-ménopausique en relais d'un traitement par bisphosphonates notamment en cas d'échec ou de mauvaise tolérance aux bisphosphonates. Il est contre-indiqué en cas d'hypocalcémie. Comme les bisphosphonates, il est associé à un risque rare d'ostéonécrose de la mâchoire.Médicament stimulant la formation osseuse
Tériparatide
Le tériparatide est le fragment recombinant 1–34 de la parathormone. Ce fragment est en effet ostéoformateur lorsqu'il est administré quotidiennement par voie sous-cutanée à la dose de 20 μg pendant une durée de 18 à 24 mois. Sa prescription s'intègre dans un traitement séquentiel car, à l'issue de cette durée, un relais doit être pris par un traitement anti-résorbeur. Le tériparatide augmente le remodelage osseux au bénéfice de la formation osseuse et induit une augmentation de la DMO et une diminution de l'incidence des fractures vertébrales et non vertébrales. Il est remboursé pour les formes sévères avec au moins deux fractures vertébrales. Son utilisation est contre-indiquée en cas d'hypercalcémie, de maladies métaboliques osseuses autres que l'ostéoporose post-ménopausique, d'antécédent de radiothérapie et en cas de tumeur osseuse ou de métastases.Seuls l'alendronate, le risédronate, l'acide zolédronique et le tériparatide font l'objet d'une AMM en France et d'un remboursement. Le dénosumab peut être prescrit mais n'est pas remboursé.
En dehors des mesures générales toujours indiquées dans la prise en charge de l'ostéoporose post-ménopausique, il est parfois nécessaire d'introduire un traitement antiostéoporotique. La mesure de la DMO est nécessaire avant toute décision thérapeutique. On peut distinguer plusieurs situations (tableau 7.1).
Tableau 7.1 : 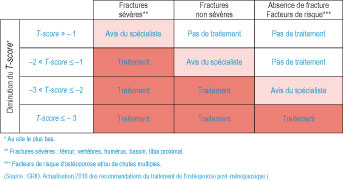
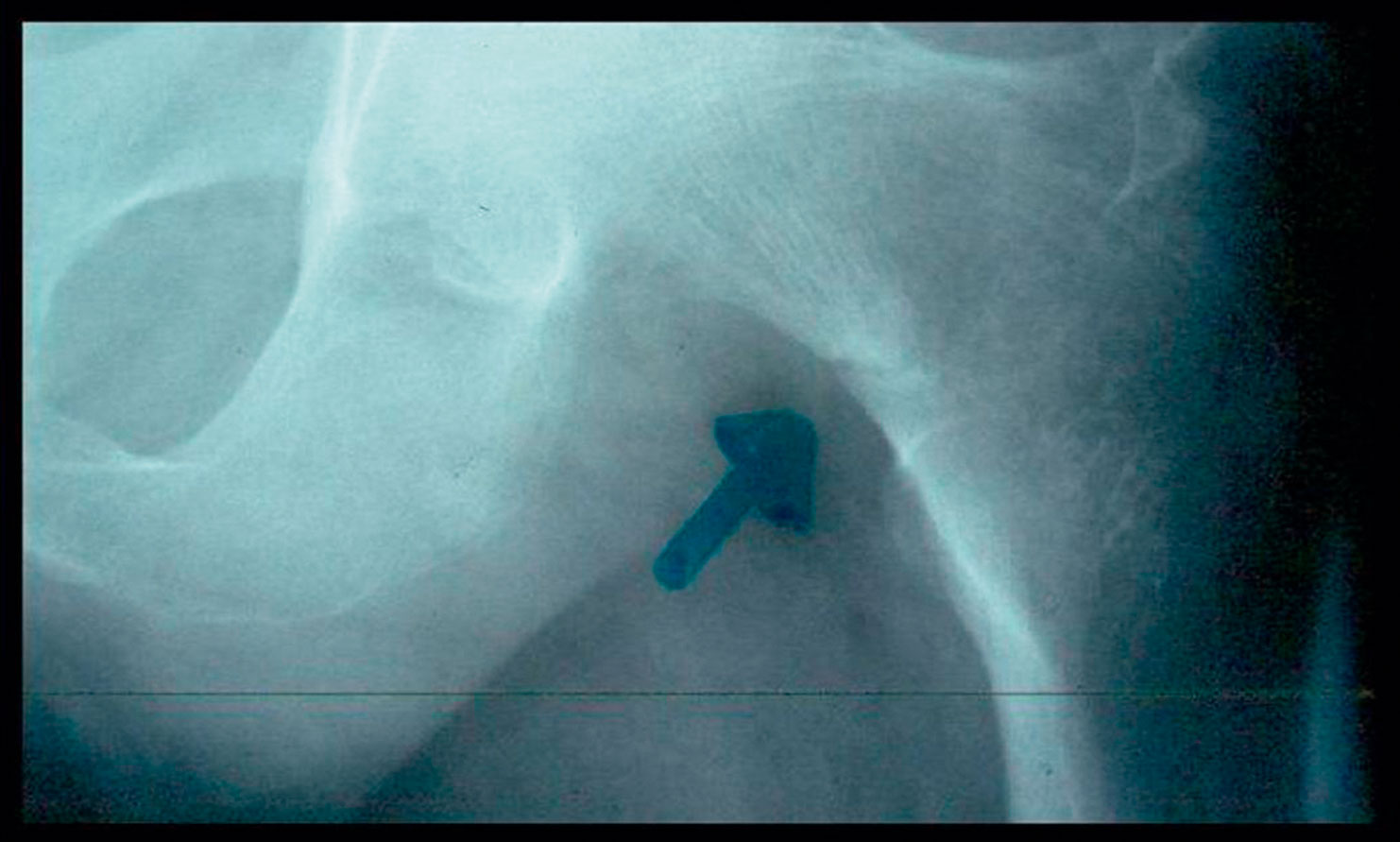
Fig. 7-4 :![]() Fissures ou stries de Looser-Milkman du col du fémur.
Fissures ou stries de Looser-Milkman du col du fémur.
La DMO met en évidence une diminution importante de la densité osseuse.
Devant une fracture sévère (vertèbre, FESF, FESH, bassin)
Un traitement est impératif quel que soit l'âge si le T-score est ≤ – 1.Devant une fracture non sévère
Une mesure de la DMO peut être proposée dans les 2 à 3 ans après le début du traitement et en fin de séquence de traitement (5 ans pour les bisphosphonates per os et 3 ans pour les bisphosphonates injectables). À la fin de la première séquence de traitement, la poursuite ou l'arrêt du traitement sont à évaluer selon certains critères (nouvelles fractures, DMO…).
Il existe des marqueurs biologiques du remodelage osseux capables d'évaluer l'activité de formation osseuse (ostéocalcine, phosphatases alcalines osseuses, peptides d'extension du procollagène І : P1NP) ou l'activité de résorption osseuse (télopeptides du collagène : CTX). Ces marqueurs sériques n'ont pas leur place dans le diagnostic ni le bilan initial d'une ostéoporose. Ils sont utiles lors du suivi de traitements par anti-résorbeurs pour évaluer l'observance à ces traitements et la réponse pharmacologique dès les premiers mois, avant les variations densitométriques.
L'évaluation morphologique du rachis est indiquée chez une femme ménopausée traitée s'il existe des rachialgies et/ou une perte de taille prospective ≥ 2 cm.
![]() L'ostéomalacie carentielle d'apport en vitamine D est devenue rare dans les pays développés. Elle peut s'observer notamment chez des migrants récents ou des personnes âgées ne bénéficiant pas, du fait de leurs conditions de vie, de leur mode d'habillement, d'une exposition au soleil ou d'apports alimentaires suffisants. L'ostéomalacie carentielle par malabsorption digestive est rare dans la population générale.
L'ostéomalacie carentielle d'apport en vitamine D est devenue rare dans les pays développés. Elle peut s'observer notamment chez des migrants récents ou des personnes âgées ne bénéficiant pas, du fait de leurs conditions de vie, de leur mode d'habillement, d'une exposition au soleil ou d'apports alimentaires suffisants. L'ostéomalacie carentielle par malabsorption digestive est rare dans la population générale.
![]() La carence en vitamine D peut être la conséquence :
La carence en vitamine D peut être la conséquence :
Remarque : Des troubles du métabolisme de la vitamine D (défaut d'hydroxylation…) ou la résistance de ses organes cibles à l'action de la vitamine D active (calcitriol ou 1,25(OH)2-vitamine D) sont d'autres causes d'ostéomalacies en lien avec la vitamine D.
Il s'agit essentiellement de la fuite rénale des phosphates par diminution de leur taux de réabsorption tubulaire.
![]() Les manifestations cliniques sont indépendantes de l'étiologie :
Les manifestations cliniques sont indépendantes de l'étiologie :
![]() Les signes radiologiques peuvent être manquants au début. Leur absence ne permet pas d'écarter le diagnostic. Ils sont indépendants de l'étiologie :
Les signes radiologiques peuvent être manquants au début. Leur absence ne permet pas d'écarter le diagnostic. Ils sont indépendants de l'étiologie :
Fig. 7-4 :![]() Fissures ou stries de Looser-Milkman du col du fémur.
Fissures ou stries de Looser-Milkman du col du fémur.
La DMO met en évidence une diminution importante de la densité osseuse.

![]() En cas d'ostéomalacie par carence en vitamine D, les arguments biologiques sont de grande valeur diagnostique et caractérisés par :
En cas d'ostéomalacie par carence en vitamine D, les arguments biologiques sont de grande valeur diagnostique et caractérisés par :
Le diagnostic de la carence en vitamine D repose sur le dosage de la 25(OH)-vitamine D. La carence en vitamine D est définie par une valeur de 25(OH)-vitamine D < 10 ng/ml (25 nmol/l). L'insuffisance en vitamine D est définie par une valeur comprise entre 10 et 30 ng/ml (25 à 75 nmol/l).
Actuellement, la concentration de 25(OH)-vitamine D recommandée est comprise entre 30 et 70 ng/ml (75 à 175 nmol/l) et le risque d'intoxication en vitamine D, qui est exceptionnel, apparaît pour des concentrations supérieures à 150 ng/ml (375 nmol/l).![]() Le rapport de la HAS (2013) recommande de dépister une carence en vitamine D seulement dans les cas suivants :
Le rapport de la HAS (2013) recommande de dépister une carence en vitamine D seulement dans les cas suivants :
![]() Il faut adapter le traitement à chaque étiologie d'ostéomalacie (régime sans gluten en cas de maladie cœliaque, par exemple).
Il faut adapter le traitement à chaque étiologie d'ostéomalacie (régime sans gluten en cas de maladie cœliaque, par exemple).
En cas de défaut d'apport : supplémentation en vitamine D et en calcium.
Légende :
Dans le respect de la Réforme du deuxième cycle des études médicales (R2C), les connaissances rassemblées sur ce site sont hiérarchisées en rang A, rang B et rang C à l'aide de balises et d'un code couleur :
![]() Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
![]() Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
![]() Connaissances spécifiques à un DES donné (troisième cycle).
Connaissances spécifiques à un DES donné (troisième cycle).
