Biothérapies et thérapies ciblées
Item 202 UE VIII
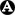
Une
thérapie ciblée est un médicament sélectif qui cible de manière spécifique un récepteur, un gène, une protéine ou une voie de signalisation impliquée dans un processus pathologique. Cette notion s'oppose aux médicaments non ciblés qui ont une action plus globale et souvent moins bien comprise. Ces thérapies ciblées ont connu un essor spectaculaire ces dernières années à la fois grâce à des évolutions technologiques mais également par une meilleure compréhension des mécanismes physiopathologiques.
Les
biothérapies incluent les thérapies tissulaires (greffe de tissus vivants), les thérapies cellulaires, la thérapie génique et les biomédicaments.
Seuls les
thérapies ciblées et les
biomédicaments utilisés en rhumatologie seront développés dans ce référentiel.
1 - Introduction et nomenclature
Les traitements de fond se distinguent des traitements dits « symptomatiques » (antalgiques, anti-inflammatoires, etc.). Leur utilisation a pour objectif de contrôler la maladie inflammatoire sur le long terme tout en réduisant la consommation des traitements symptomatiques. Dans la nomenclature anglo-saxonne, qui tend à s'imposer, nous parlons de DMARD (Disease-Modifying AntiRheumatic Drugs) pour désigner ces traitements de fond.
On distingue deux classes de traitements de fond ou DMARD, conventionnel et ciblés :
- les traitements conventionnels csDMARD (conventional synthetic DMARD) sont représentés principalement par le méthotrexate et le léflunomide, mais également par la sulfasalazine et l'hydroxychloroquine ;
- les traitements ciblés comportent les DMARD biologiques, ou bDMARD, et les traitements ciblés synthétiques, ou tsDMARD (targeted synthetic DMARD) :
– les bDMARD sont représentés par les anti-TNF, les anti-récepteurs de l'IL-6, les anti-IL-1 (anticorps anti-IL-1 et récepteur antagoniste de l'IL-1), les anti-IL-12, les anti-IL-17, les anti-IL-23, les anti-lymphocytes B déplétants (anti-CD20, rituximab), les antagonistes de l'activation des lymphocytes B (anti-BAFF, bélimumab) ou des lymphocytes T (CTLA4-Ig, abatacept) ;
– les tsDMARD sont essentiellement représentés par les inhibiteurs de Janus kinases ou JAKi et un inhibiteur de la phosphodiestérase (aprémilast).
 Parmi les bDMARD, on distingue les originaux (boDMARD) et les biosimilaires (bsDMARD), qui sont sur le marché français depuis 2016. Les biosimilaires correspondent à des copies des molécules originales mais qui doivent démontrer une efficacité et une tolérance similaires à la molécule originale dans un essai clinique randomisé en double aveugle. Leur coût est moins élevé et peut permettre d'envisager des économies.
Parmi les bDMARD, on distingue les originaux (boDMARD) et les biosimilaires (bsDMARD), qui sont sur le marché français depuis 2016. Les biosimilaires correspondent à des copies des molécules originales mais qui doivent démontrer une efficacité et une tolérance similaires à la molécule originale dans un essai clinique randomisé en double aveugle. Leur coût est moins élevé et peut permettre d'envisager des économies.
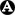
Il existe actuellement
deux principaux modes d'action des biomédicaments utilisés en rhumatologie (fig. 22.1).
Fig. 22-1 : Mécanismes d'action des différents biomédicaments (bDMARD).
Mécanismes d'action des différents biomédicaments (bDMARD).
Les cibles des différents biomédicaments sont précisées avec soit neutralisation d'une cytokine soit interaction avec une molécule située à la surface d'une cellule.
CPA : cellule présentatrice d'antigènes ; LT : lymphocyte T ; LB : lymphocyte B. CTLA4 : Cytotoxic T-Lymphocyte-Associated protein 4. IL : interleukine ; TNF : Tumor Necrosis factor ; TCR : T cell receptor ; BAFF : B cell Activated Factor ; CD : Cluster of Differenciation.
(Adapté de Morel et al. Médecine/sciences 2019 ;35:1029–33.)
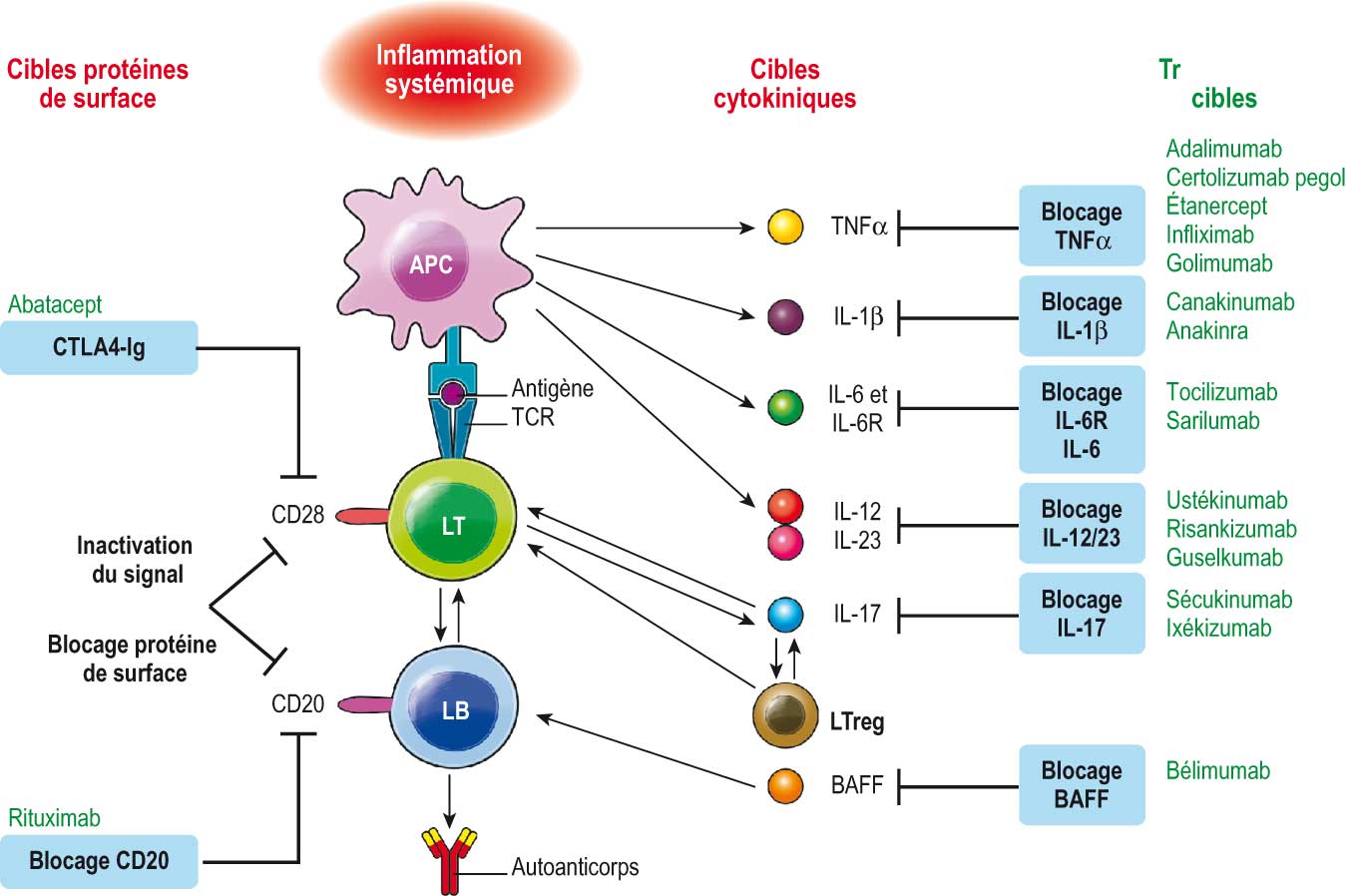
Le
premier mode d'action consiste à neutraliser directement une cytokine impliquée dans l'immunité (par exemple, TNF, IL-17, IL-23, IL-1) ou bloquer le récepteur sur lequel se lie à la cytokine (par exemple, récepteurs de l'IL-6, de l'IL-1, de l'IL-12).
Le
deuxième mode d'action consiste à cibler une molécule membranaire spécifique d'une cellule qui peut :
- soit réguler l'activation cellulaire (CTLA4/CD28, abatacept ; BAFF, bélimumab) ;
- soit induire la mort de la cellule (CD20, rituximab).
Un biomédicament peut se faire :
- par le développement d'un anticorps monoclonal (suffixe -mab) qui reconnaît directement la cytokine ou son récepteur ;
- par la fabrication d'une protéine de fusion (suffixe -cept) composée d'une part d'un récepteur (par exemple, étanercept) ou d'une molécule de surface cellulaire (par exemple, abatacept), et une fraction Fc d'une immunoglobuline d'autre part.
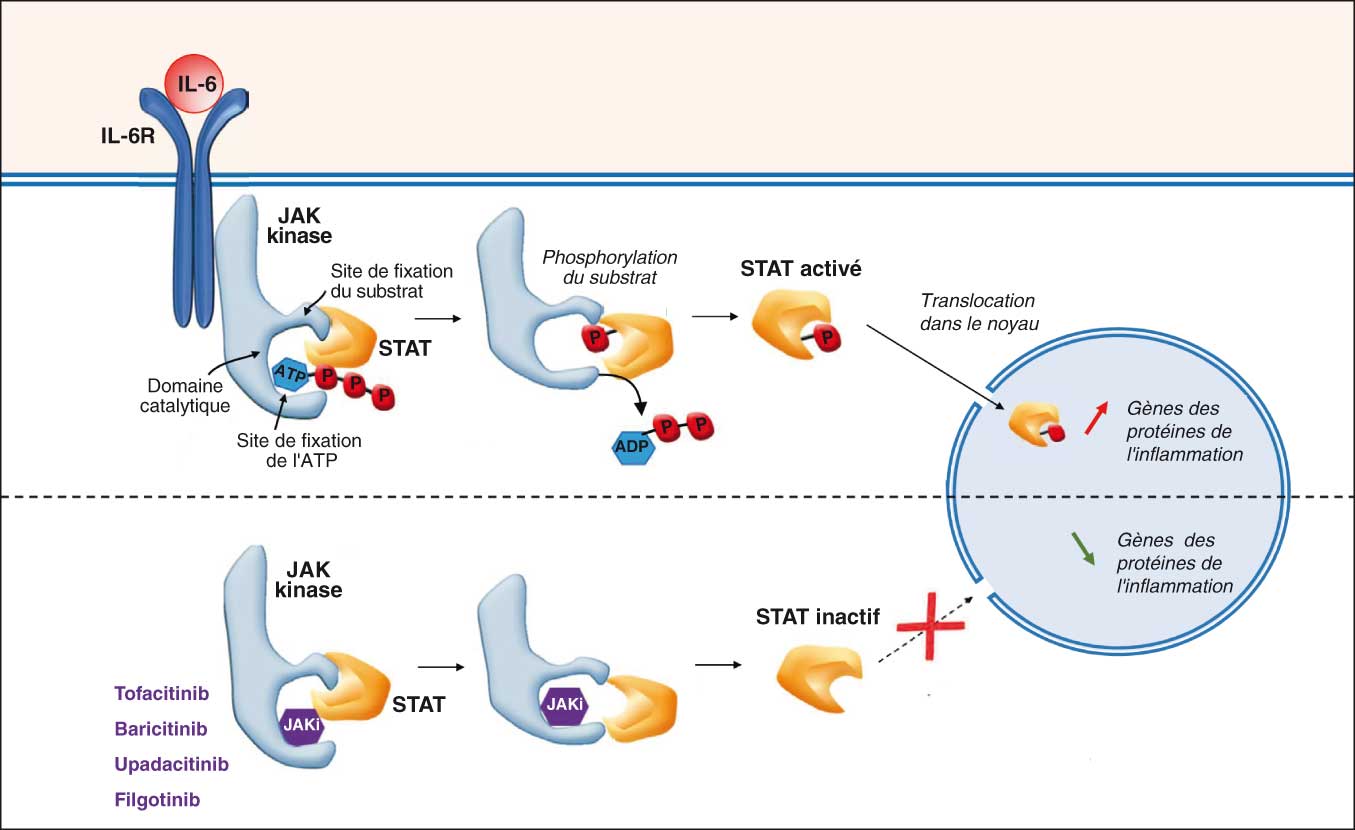
Les inhibiteurs de kinases sont de petites protéines de synthèse chimique capables de neutraliser l'activation des tyrosine kinases comme JAK (fig. 22.2). Il existe quatre isotypes différents de JAK : JAK1, JAK2, JAK3 et Tyk2. Les JAK sont activées après la liaison entre la cytokine (par exemple, l'IL-6) et son récepteur (IL-6R) et induisent une phosphorylation du facteur de transcription STAT qui peut, sous cette forme phosphorylée, franchir l'enveloppe nucléaire et se fixer sur les gènes codant des protéines de l'inflammation.
Fig. 22-2 : Mécanisme d'action des JAKi : exemple de la voie de signalisation de l'IL-6.
Mécanisme d'action des JAKi : exemple de la voie de signalisation de l'IL-6.
Le JAKi s'insère dans le domaine catalytique de la kinase JAK en place de l'ATP et empêche ainsi la phosphorylation du facteur de transcription STAT. Le facteur de transcription STAT doit être phosphorylé pour entrer dans le noyau et activer la synthèse de protéines de l'inflammation.
JAK : Janus kinase ; STAT : Signal Transducers and Activators of Transcription ; ATP : adénosine triphosphate ; ADP : adénosine diphosphate.
(Adapté de Sweeney SE et al. Nat Clin Pract Rheumatol 2007 ;3:651–60.)
2 - Molécules à disposition
 Nous disposons actuellement en France dans le domaine de la rhumatologie de :
Nous disposons actuellement en France dans le domaine de la rhumatologie de :
- cinq anti-TNF : infliximab, étanercept, adalimumab, certolizumab, golimumab ;
- un anti-lymphocyte B CD20 : rituximab ;
- un inhibiteur de la différenciation et de l'activation des lymphocytes B : bélimumab ;
- un inhibiteur de la co-activation des lymphocytes T : abatacept ;
- deux anticorps anti-récepteur de l'IL-6 : tocilizumab et sarilumab ;
- un récepteur antagoniste de l'IL-1 : anakinra ;
- un anticorps anti- IL-1 : canakinumab ;
- des anticorps anti-IL-17 : sécukinumab, ixékizumab ;
- des anticorps anti-IL-23 : rizankizumab, guselkumab ;
- un anticorps anti-IL-12/IL-23 : ustékinumab ;
- un anticorps anti-RANKL : dénosumab, dans l'ostéoporose ;
- des inhibiteurs des kinases JAK : tofacitinib, baricitinib, upadacitinib, filgotinib ;
- d'un inhibiteur de la phosphodiesterase de type 4 : aprémilast ;
- plusieurs biosimilaires sont commercialisés en France depuis 2016 pour l'infliximab, l'étanercept, l'adalimumab et le rituximab.
3 - Indications et stratégie
 Chaque thérapeutique ciblée a des indications spécifiques et toutes ne sont pas efficaces sur les mêmes pathologies.
Chaque thérapeutique ciblée a des indications spécifiques et toutes ne sont pas efficaces sur les mêmes pathologies.
Par exemple, si les anti-TNFα fonctionnent à la fois dans la polyarthrite rhumatoïde et les spondyloarthrites, les anti-IL-6R fonctionnent dans la PR et non dans les SpA et les anti-IL-17 ont un effet dans les SpA mais pas dans la PR.
- La stratégie thérapeutique dans la polyarthrite rhumatoïde (cf. fig. 17.12 au chapitre 17) débute par la prescription de csDMARD (méthotrexate et si contre-indication, léflunomide). Ce n'est qu'en cas d'échec des csDMARD incluant au moins le méthotrexate que l'on a recours à un traitement ciblé ;
- Dans les spondyloarthrites axiales, périphériques articulaires, périphériques enthésitiques (cf. fig. 18.12 au chapitre 18), un traitement ciblé peut être envisagé en cas de rhumatisme inflammatoire non contrôlé malgré les AINS dans les formes axiales et les traitements de fond synthétiques dans les formes périphériques.
 La prescription des biomédicaments (à l'exception du dénosumab) et JAKi est encadrée par une prescription initiale hospitalière (PIH). Ils ne peuvent donc être prescrits que par certaines spécialités et certains spécialistes exerçant dans une structure hospitalière ou clinique.
La prescription des biomédicaments (à l'exception du dénosumab) et JAKi est encadrée par une prescription initiale hospitalière (PIH). Ils ne peuvent donc être prescrits que par certaines spécialités et certains spécialistes exerçant dans une structure hospitalière ou clinique.
4 - Bilan précédant l'initiation d'un traitement ciblé
 La prescription d'un traitement ciblé est toujours réalisée suite à un bilan préthérapeutique complet à la recherche notamment de facteurs de risques de complications infectieuses. Il va être adapté au traitement choisi car chaque mode d'action a des spécificités sur le plan des effets indésirables. Cependant, certains éléments du bilan préthérapeutique sont communs à toutes les molécules :
La prescription d'un traitement ciblé est toujours réalisée suite à un bilan préthérapeutique complet à la recherche notamment de facteurs de risques de complications infectieuses. Il va être adapté au traitement choisi car chaque mode d'action a des spécificités sur le plan des effets indésirables. Cependant, certains éléments du bilan préthérapeutique sont communs à toutes les molécules :
- interrogatoire :
– antécédents infectieux tels qu'infections récurrentes ;
– notion d'infection tuberculeuse ou de contage tuberculeux ;
– calendrier vaccinal ; on propose une vaccination antipneumococcique ;
– suivi régulier chez le dentiste, suivi gynécologique chez la femme, etc., à adapter selon le terrain ;
– antécédents de cancer solide ou d'hémopathies ; - examen clinique :
– recherche de foyers infectieux chroniques potentiels, fièvre ;
– adénopathies périphériques ;
– signes orientant vers une néoplasie ; - examens paracliniques :
– hémogramme ;
– transaminases ;
– sérologies des hépatites B, C et du VIH ;
– bilan lipidique (cholestérol, triglycérides) pour les anti-IL-6R et les anti-JAK ;
– intradermoréaction à la tuberculine (IDR) ou, mieux, un test sanguin IGRA (Interferon-Gamma Release Assay, Quantiféron®). En cas de positivité, on recherche des arguments pour une tuberculose patente qu'il faudra traiter. Si cela n'est pas le cas, il s'agit alors d'une tuberculose latente qui nécessite de mettre en route une chimioprophylaxie antituberculeuse (rifampicine + isoniazide pendant 3 mois). Le traitement ciblé pourra être débuté après 1 mois de la chimioprophylaxie antituberculeuse ;
– radiographie du thorax et TDM thoracique en cas d'anomalie sur la radiographie standard.
5 - Surveillance d'un patient traité par traitement de fond biologique ou ciblé
 Le rapport efficacité/tolérance reste toujours en leur faveur avec vingt ans de recul maintenant pour les plus anciennes biothérapies.
Le rapport efficacité/tolérance reste toujours en leur faveur avec vingt ans de recul maintenant pour les plus anciennes biothérapies.
Les traitements ciblés sont très efficaces sur les signes inflammatoires cliniques (articulations douloureuses et gonflées), biologiques (CRP voire la VS) et limitent la destruction articulaire en particulier dans la PR et le rhumatisme psoriasique. Leur efficacité anti-inflammatoire permet également de diminuer les risques liés à l'inflammation chronique comme la survenue d'événements cardiovasculaires ou encore d'une ostéoporose.
La tolérance des traitements biologiques et ciblés est en générale bonne. Toutefois, leur tolérance doit être pondérée par plusieurs points :
-
 un taux d'infections sévères (sévérité définie par l'hospitalisation ou la mise sous antibiothérapie intraveineuse ou le décès) augmenté avec un taux d'événements pour 100 patients par année autour de 4 (intervalle de confiance à 95 % significatif), quelle que soit la molécule. Devant toute fièvre sous ce type de traitements, celui-ci doit être suspendu et une évaluation clinique réalisée en urgence
un taux d'infections sévères (sévérité définie par l'hospitalisation ou la mise sous antibiothérapie intraveineuse ou le décès) augmenté avec un taux d'événements pour 100 patients par année autour de 4 (intervalle de confiance à 95 % significatif), quelle que soit la molécule. Devant toute fièvre sous ce type de traitements, celui-ci doit être suspendu et une évaluation clinique réalisée en urgence  . L'utilisation des antibiotiques doit être large après éventuels prélèvements bactériologiques ou autres guidés par la clinique ;
. L'utilisation des antibiotiques doit être large après éventuels prélèvements bactériologiques ou autres guidés par la clinique ; -
 un surrisque tumoral concernant les cancers cutanés non mélanomateux qui justifie une surveillance cutanée régulière.
un surrisque tumoral concernant les cancers cutanés non mélanomateux qui justifie une surveillance cutanée régulière.
5.1 - Surveillance d'un patient traité par traitement de fond biologique ou ciblé
 La surveillance clinique sera réalisée au cours de consultations de suivi auprès du rhumatologue. En plus de l'évaluation de l'efficacité, elle est principalement centrée sur la recherche d'éléments en faveur d'une infection présente ou passée. Les infections les plus fréquentes concernent la sphère ORL et pulmonaire. Des infections opportunistes comme la tuberculose peuvent débuter par un amaigrissement ou une fébricule.
La surveillance clinique sera réalisée au cours de consultations de suivi auprès du rhumatologue. En plus de l'évaluation de l'efficacité, elle est principalement centrée sur la recherche d'éléments en faveur d'une infection présente ou passée. Les infections les plus fréquentes concernent la sphère ORL et pulmonaire. Des infections opportunistes comme la tuberculose peuvent débuter par un amaigrissement ou une fébricule.
 La surveillance biologique est simple et comporte à 3 mois de l'initiation du traitement ciblé : un hémogramme, des transaminases, une créatinine, en ajoutant un bilan lipidique pour les anti-IL-6 et les inhibiteurs de JAK pour vérifier la tolérance et une CRP (voire VS) pour vérifier l'efficacité.
La surveillance biologique est simple et comporte à 3 mois de l'initiation du traitement ciblé : un hémogramme, des transaminases, une créatinine, en ajoutant un bilan lipidique pour les anti-IL-6 et les inhibiteurs de JAK pour vérifier la tolérance et une CRP (voire VS) pour vérifier l'efficacité.
5.2 - Situations nécessitant un ajustement des traitements de fond biologique ou ciblé
 Le traitement ciblé doit être arrêté en cas d'infection
Le traitement ciblé doit être arrêté en cas d'infection  en dehors de la rhinopharyngite simple (rhume) non surinfectée. Une antibiothérapie sera envisagée en cas d'infection bactérienne après les prélèvements bactériologiques. En cas de signes atypiques et devant toute altération de l'état général, une infection opportuniste doit être évoquée et le patient sera adressé au spécialiste pour un bilan étiologique plus précis.
en dehors de la rhinopharyngite simple (rhume) non surinfectée. Une antibiothérapie sera envisagée en cas d'infection bactérienne après les prélèvements bactériologiques. En cas de signes atypiques et devant toute altération de l'état général, une infection opportuniste doit être évoquée et le patient sera adressé au spécialiste pour un bilan étiologique plus précis.
 La vaccination du patient et de son entourage est une mesure préventive importante pour réduire le risque infectieux :
La vaccination du patient et de son entourage est une mesure préventive importante pour réduire le risque infectieux :
- les vaccins inactivés (DTP, grippe, pneumocoque) peuvent être réalisés sans arrêter le traitement ciblé ;
- les vaccins vivants comme le vaccin anti-amarile (fièvre jaune), le ROR sont par contre contre-indiqués et nécessitent un arrêt du traitement 3 mois (6 mois pour le rituximab) avant leur réalisation.
La majorité des traitements ciblés doivent être arrêtés en cas de chirurgie ou de grossesse et il convient d'adresser le patient ou la patiente au spécialiste qui a prescrit le traitement.
Il n'y a aucune contre-indication à voyager quand on est traité par thérapie ciblée ou biomédicament. Il est conseillé d'être en possession d'une information écrite (si possible en anglais) concernant le traitement (dose et dates) et de respecter les modalités de conservations propres à chaque molécule. Sur place, les mesures d'hygiène et les précautions vis-à-vis de l'alimentation et des insectes doivent être respectées. En cas de fièvre ou de symptômes d'infection, il faut consulter rapidement.
Légende :
Dans le respect de la Réforme du deuxième cycle des études médicales (R2C), les connaissances rassemblées sur ce site sont hiérarchisées en rang A, rang B et rang C à l'aide de balises et d'un code couleur :
 Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
 Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
 Connaissances spécifiques à un DES donné (troisième cycle).
Connaissances spécifiques à un DES donné (troisième cycle).
![]() Mécanismes d'action des différents biomédicaments (bDMARD).
Mécanismes d'action des différents biomédicaments (bDMARD).
![]() Mécanisme d'action des JAKi : exemple de la voie de signalisation de l'IL-6.
Mécanisme d'action des JAKi : exemple de la voie de signalisation de l'IL-6.
![]() Nous disposons actuellement en France dans le domaine de la rhumatologie de :
Nous disposons actuellement en France dans le domaine de la rhumatologie de :![]() Chaque thérapeutique ciblée a des indications spécifiques et toutes ne sont pas efficaces sur les mêmes pathologies.
Chaque thérapeutique ciblée a des indications spécifiques et toutes ne sont pas efficaces sur les mêmes pathologies.![]() La prescription des biomédicaments (à l'exception du dénosumab) et JAKi est encadrée par une prescription initiale hospitalière (PIH). Ils ne peuvent donc être prescrits que par certaines spécialités et certains spécialistes exerçant dans une structure hospitalière ou clinique.
La prescription des biomédicaments (à l'exception du dénosumab) et JAKi est encadrée par une prescription initiale hospitalière (PIH). Ils ne peuvent donc être prescrits que par certaines spécialités et certains spécialistes exerçant dans une structure hospitalière ou clinique.![]() La prescription d'un traitement ciblé est toujours réalisée suite à un bilan préthérapeutique complet à la recherche notamment de facteurs de risques de complications infectieuses. Il va être adapté au traitement choisi car chaque mode d'action a des spécificités sur le plan des effets indésirables. Cependant, certains éléments du bilan préthérapeutique sont communs à toutes les molécules :
La prescription d'un traitement ciblé est toujours réalisée suite à un bilan préthérapeutique complet à la recherche notamment de facteurs de risques de complications infectieuses. Il va être adapté au traitement choisi car chaque mode d'action a des spécificités sur le plan des effets indésirables. Cependant, certains éléments du bilan préthérapeutique sont communs à toutes les molécules :![]() Le rapport efficacité/tolérance reste toujours en leur faveur avec vingt ans de recul maintenant pour les plus anciennes biothérapies.
Le rapport efficacité/tolérance reste toujours en leur faveur avec vingt ans de recul maintenant pour les plus anciennes biothérapies.![]() La surveillance clinique sera réalisée au cours de consultations de suivi auprès du rhumatologue. En plus de l'évaluation de l'efficacité, elle est principalement centrée sur la recherche d'éléments en faveur d'une infection présente ou passée. Les infections les plus fréquentes concernent la sphère ORL et pulmonaire. Des infections opportunistes comme la tuberculose peuvent débuter par un amaigrissement ou une fébricule.
La surveillance clinique sera réalisée au cours de consultations de suivi auprès du rhumatologue. En plus de l'évaluation de l'efficacité, elle est principalement centrée sur la recherche d'éléments en faveur d'une infection présente ou passée. Les infections les plus fréquentes concernent la sphère ORL et pulmonaire. Des infections opportunistes comme la tuberculose peuvent débuter par un amaigrissement ou une fébricule.![]() La surveillance biologique est simple et comporte à 3 mois de l'initiation du traitement ciblé : un hémogramme, des transaminases, une créatinine, en ajoutant un bilan lipidique pour les anti-IL-6 et les inhibiteurs de JAK pour vérifier la tolérance et une CRP (voire VS) pour vérifier l'efficacité.
La surveillance biologique est simple et comporte à 3 mois de l'initiation du traitement ciblé : un hémogramme, des transaminases, une créatinine, en ajoutant un bilan lipidique pour les anti-IL-6 et les inhibiteurs de JAK pour vérifier la tolérance et une CRP (voire VS) pour vérifier l'efficacité.![]() Le traitement ciblé doit être arrêté en cas d'infection
Le traitement ciblé doit être arrêté en cas d'infection ![]() en dehors de la rhinopharyngite simple (rhume) non surinfectée. Une antibiothérapie sera envisagée en cas d'infection bactérienne après les prélèvements bactériologiques. En cas de signes atypiques et devant toute altération de l'état général, une infection opportuniste doit être évoquée et le patient sera adressé au spécialiste pour un bilan étiologique plus précis.
en dehors de la rhinopharyngite simple (rhume) non surinfectée. Une antibiothérapie sera envisagée en cas d'infection bactérienne après les prélèvements bactériologiques. En cas de signes atypiques et devant toute altération de l'état général, une infection opportuniste doit être évoquée et le patient sera adressé au spécialiste pour un bilan étiologique plus précis.![]() La vaccination du patient et de son entourage est une mesure préventive importante pour réduire le risque infectieux :
La vaccination du patient et de son entourage est une mesure préventive importante pour réduire le risque infectieux :![]() Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.![]() Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.![]() Connaissances spécifiques à un DES donné (troisième cycle).
Connaissances spécifiques à un DES donné (troisième cycle).