Arthropathie microcristalline
Item 198 UE VIII
1 - Pour comprendre
 Les rhumatismes microcristallins sont caractérisés par des dépôts intra-articulaires ou périarticulaires de microcristaux. Ces dépôts peuvent rester asymptomatiques ou être à l'origine d'accès inflammatoires aigus ou, parfois, d'arthropathies chroniques.
Les rhumatismes microcristallins sont caractérisés par des dépôts intra-articulaires ou périarticulaires de microcristaux. Ces dépôts peuvent rester asymptomatiques ou être à l'origine d'accès inflammatoires aigus ou, parfois, d'arthropathies chroniques.
C'est l'archétype de l'inflammation aiguë en pathologie humaine.
Trois types de microcristaux sont en cause :
- cristaux d'urate de sodium (UMS pour urate monosodique), responsables de la goutte ;
- cristaux calciques :
– de type pyrophosphate de calcium (PPC) pour le rhumatisme associé ;
– de type phosphate de calcium, apatite surtout, pour des dépôts radiopaques habituellement périarticulaires.
Les cristaux d'UMS et de PPC sont microscopiques et observables en microscopie optique. Ceux de phosphate de calcium sont submicroscopiques et ne peuvent pas être observés en microscopie optique.
Les cristaux d'acide urique existent uniquement dans les voies urinaires  .
.
Les caractéristiques sémiologiques des accès microcristallins articulaires ou péri-articulaires typiques sont les suivantes :
- début brutal ;
- forte intensité de la douleur et de l'inflammation locale (rougeur en particulier) ;
- EVA ou EN douleur ≥ 7/10 ;
- maximum des symptômes en moins de 24 heures ;
- rougeur locale parfois très intense (rouge pivoine classiquement) ;
- résolution spontanée en quelques jours à quelques semaines avec restauration (initiale) ad integrum de l'articulation au début de la maladie.
Cette description est valable pour l'accès de goutte mais aussi pour les autres crises microcristallines  .
.
Le terrain — un peu caricaturé pour la forme typique — diffère selon la maladie :
- homme mûr, souvent en surpoids ou obèse, atteint de maladies cardiovasculaires, d'insuffisance rénale ou de diabète sucré pour la goutte ;
- sujet âgé pour le rhumatisme à cristaux de PPC ;
- femme plus jeune pour les crises calciques apatitiques.
Le site de l'arthrite ou de la périarthrite aiguë peut parfois orienter le diagnostic :
- la goutte donne pendant les premières années des accès aigus de l'articulation métatarsophalangienne (MTP) du gros orteil ou d'une autre articulation du pied (autres MTP, tarse, cheville) ;
- le rhumatisme à pyrophosphate, autrefois appelé chondrocalcinose, se manifeste souvent par une arthrite du genou ou du poignet (arthrite aiguë à PPC, anciennement appelée pseudo-goutte) ;
- les accès périarticulaires liés aux dépôts apatitiques touchent souvent l'épaule par tendinite calcifiante des muscles de la coiffe, ou la main avec de pseudo-phlegmons/abcès/cellulites récidivants des doigts ou des poignets.
L'inflammation aiguë causée par les cristaux peut être à l'origine de signes généraux (fièvre, voire frissons) et d'une réaction inflammatoire biologique (élévation de la CRP, voire de la VS, hyperleucocytose)  .
.
Ces signes peuvent faire craindre et suspecter une infection articulaire — l'arthrite septique est le principal diagnostic différentiel (+++) —, un abcès ou une cellulite infectieuse. Ils peuvent aussi correspondre à une infection associée, cause déclenchante classique d'un accès de goutte ou de pseudo-goutte. Ce tableau clinique explique les passages aux urgences et les hospitalisations.
Les clés du diagnostic sont :
- le terrain ;
- les caractéristiques cliniques de l'accès aigu et sa répétition ;
- l'analyse du liquide synovial :
– présence d'un liquide articulaire inflammatoire (cellularité supérieure à 2 000 cellules nucléées/mm3, parfois très élevée jusqu'à 100 000/mm3) à prédominance de polynucléaires neutrophiles, et de microcristaux :
.  d'UMS (cristaux fins allongés, pointus, fortement biréfringents en lumière polarisée) ;
d'UMS (cristaux fins allongés, pointus, fortement biréfringents en lumière polarisée) ;
. ou de PPC (cristaux courts, carrés ou rectangulaires, négativement ou faiblement biréfringents), typiquement en position intracellulaire voire extracellulaire ;
–  et la négativité des examens bactériologiques systématiques (association possible) ;
et la négativité des examens bactériologiques systématiques (association possible) ; - la radiographie standard, à la recherche de dépôts calciques, radio-opaques, péri-articulaires pour les accès apatitiques, ou intra-articulaires pour le rhumatisme à PPC. Elle est normale dans la goutte débutante sauf à montrer une arthrose associée ;
-
 l'échographie articulaire utile pour le diagnostic de goutte (classification EULAR/ACR 2015) ;
l'échographie articulaire utile pour le diagnostic de goutte (classification EULAR/ACR 2015) ; -
 les dépôts d'UMS sous forme de tophus goutteux intra- ou périarticulaire cliniquement décelables.
les dépôts d'UMS sous forme de tophus goutteux intra- ou périarticulaire cliniquement décelables.
Une recherche de microcristaux doit être réalisée sur tout liquide articulaire d'arthrite indifférenciée ou d'arthrite récidivante inclassée  .
.
2 - Tableau clinique des arthropathies microcristallines
2.1 - Goutte
 La goutte est à la fois :
La goutte est à la fois :
- une maladie de surcharge en urates, sel d'acide urique ;
- une maladie chronique de ce fait ;
- une maladie à forte composante génétique (familiale) ;
- un rhumatisme inflammatoire intermittent, le plus fréquent en France.
Elle est réversible et donc peut « guérir »  moyennant un traitement visant à abaisser durablement le taux d'acide urique, et cela de façon permanente.
moyennant un traitement visant à abaisser durablement le taux d'acide urique, et cela de façon permanente.
2.1.1 - Épidémiologie
La prévalence de la goutte en France est de 0,9 % chez les adultes. La goutte est aussi le rhumatisme inflammatoire intermittent le plus fréquent dans les pays industrialisés (prévalence moyenne de 1,4 %, 0,9 % en France), en particulier chez l'homme adulte.
2.1.2 - Pathogénie de la cristallisation
La goutte résulte d'une hyperuricémie chronique supérieure à 360 μmol/l (60 mg/l), seuil de saturation du plasma en urate de sodium à 35 °C (température des extrémités) et donc de cristallisation  .
.
Cette valeur correspond aussi à l'uricémie « cible » qu'il faut atteindre après initiation d'un traitement hypo-uricémiant. Comme ce phénomène de cristallisation est réversible, abaisser l'uricémie en dessous de cette valeur permet la dissolution des cristaux (fig. 19.1).
Fig. 19-1 : Principe de formation de cristaus d'urate ou d'acide urique soluble selon l'uricémie.
Principe de formation de cristaus d'urate ou d'acide urique soluble selon l'uricémie.
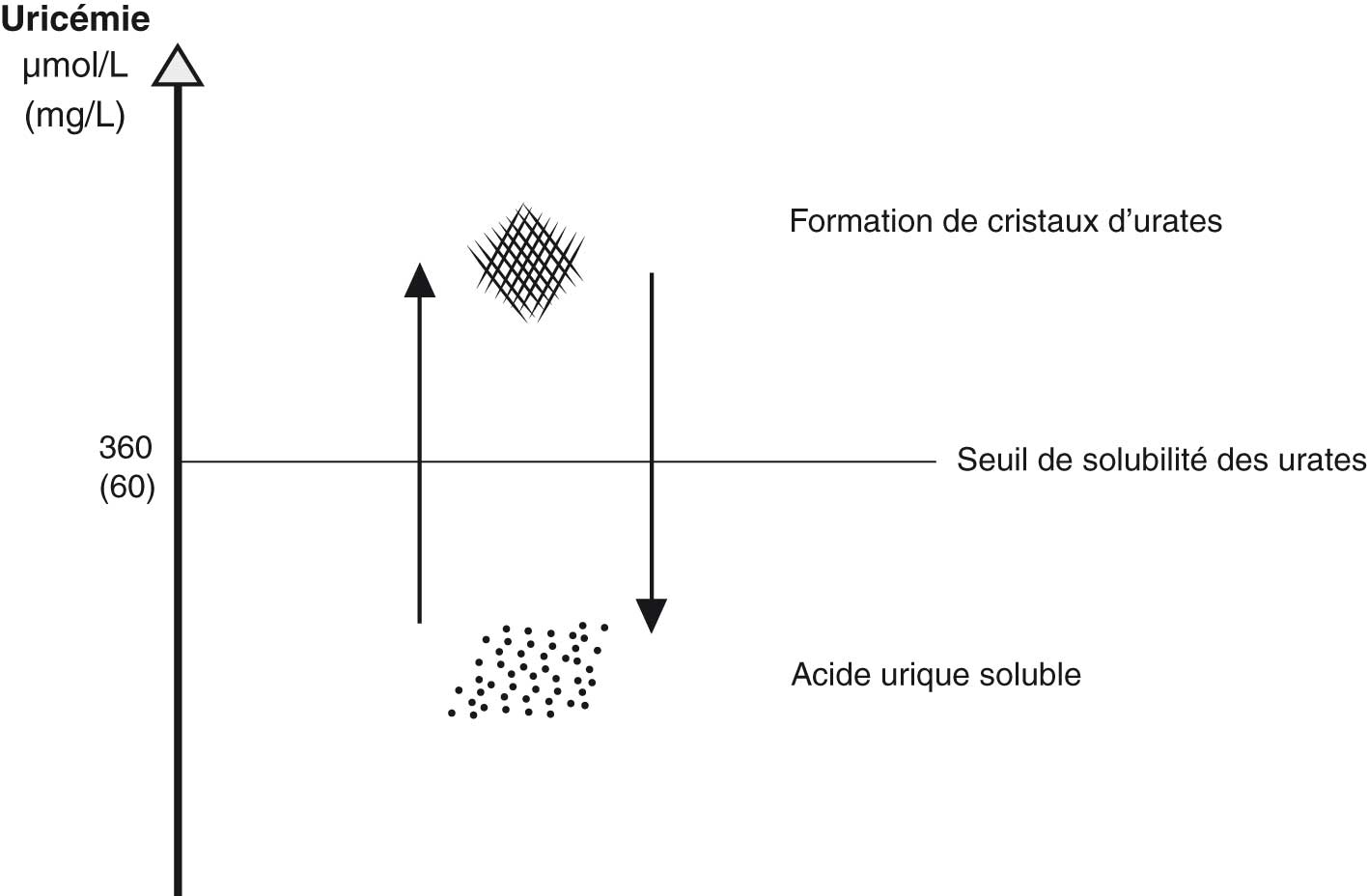
Au pH neutre des tissus, l'équilibre entre l'acide urique et son sel est déplacé vers l'urate de sodium, dont les dépôts cristallins se forment très lentement : la goutte est donc une maladie de surcharge.
Les microcristaux d'UMS libérés dans les articulations sont responsables d'accès articulaires aigus et, avec le temps, de la constitution de dépôts tissulaires d'UMS en amas, les
tophus goutteux.
Les arthropathies chroniques sont la conséquence des tophus intra-articulaires et osseux.
Dans les urines, le pH peut être acide (inférieur à 6), ce qui, en cas d'hyperuricurie, permet la formation de lithiases, faites d'acide urique qui cristallise très vite, pouvant donner des crises de colique néphrétique en aigu, et de néphropathie urique potentielle en cas de chronicisation.
2.1.3 - Manifestations cliniques
 La goutte peut donner lieu aux manifestations suivantes :
La goutte peut donner lieu aux manifestations suivantes :
- accès goutteux : c'est la principale manifestation clinique à connaître. Ils débutent très habituellement au membre inférieur, en particulier au pied (articulation MTP du gros orteil, cheville, puis de façon ascendante au genou). Les crises se résolvent d'elles-mêmes ou sont raccourcies ou bloquées par les traitements de la crise. Elles récidivent en l'absence de traitement hypo-uricémiant avec une fréquence variable, entre semaines, mois ou années. Les crises se rapprochent souvent. À ce stade d'accès aigus, les articulations sont normales entre les crises. Après plusieurs années, ils peuvent toucher les membres supérieurs. La goutte touche exceptionnellement le rachis, la hanche, l'épaule. Des oligoarthrites ou des polyarthrites goutteuses sont possibles ;
- arthropathies chroniques : si la goutte n'est pas traitée, des arthropathies chroniques peuvent se constituer. Elles se traduisent par des douleurs mécaniques chroniques émaillées de crises inflammatoires, particulières par la présence des tophus visibles sous la peau en regard ;
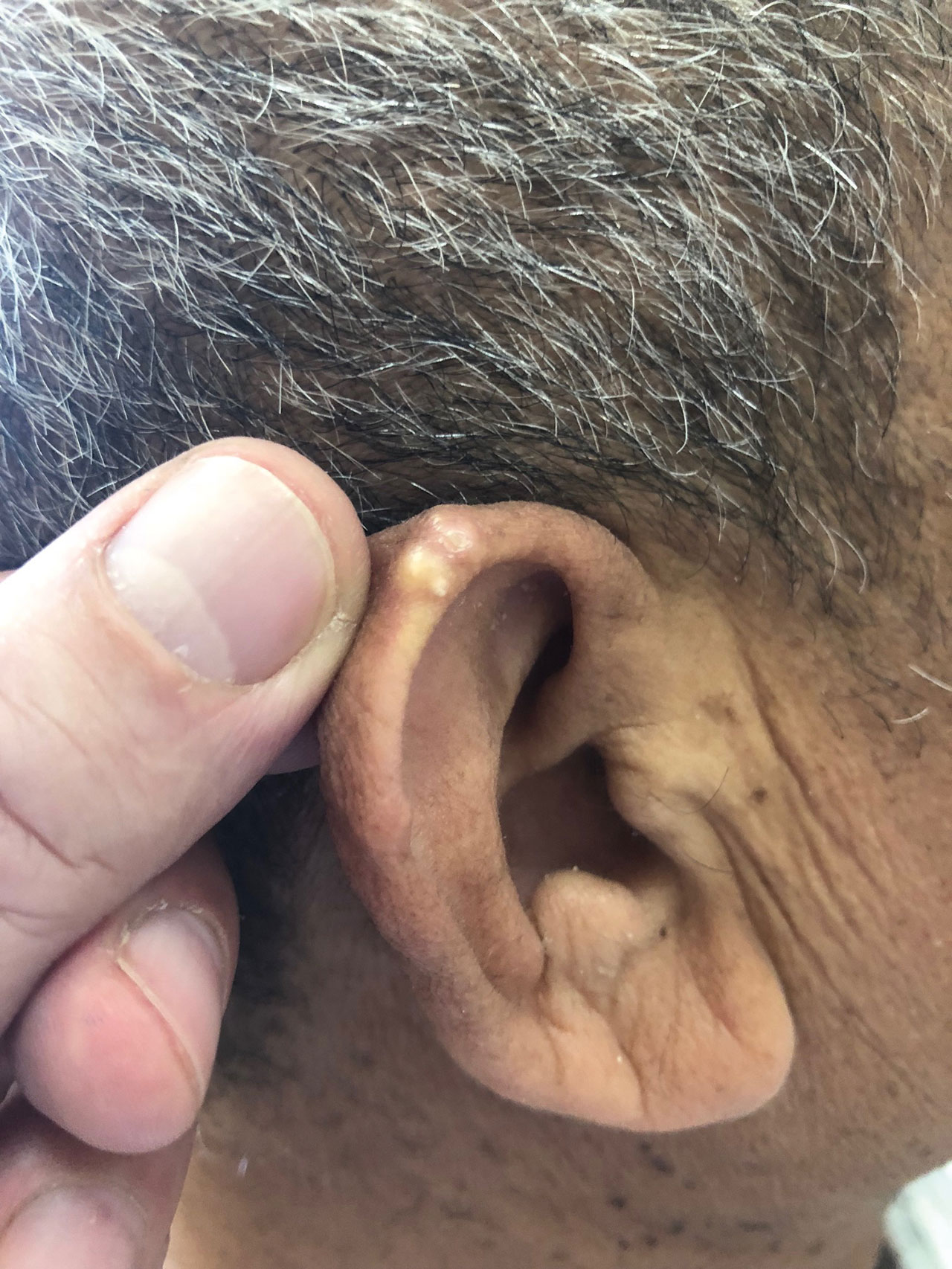
- tophus : ils se localisent autour des articulations atteintes, mais aussi dans des sites électifs : pavillon ou hélix (zone cartilagineuse) de l'oreille (fig. 19.2), coudes (bursite olécrânienne), tendons calcanéen et patellaire, articulations interphalangiennes distales ou pulpe des doigts chez les patients sous diurétiques ;
Fig. 19-2 : Tophus goutteux du pavillon de l'oreille droite.
Tophus goutteux du pavillon de l'oreille droite.
- manifestations rénales :
– la lithiase urique bilatérale (lithiase d'organisme) et radiotransparente, à l'origine de crises de colique néphrétique chez des sujets hyperexcréteurs ;
–  ces lithiases sont favorisées par un pH urinaire bas, une uricurie des 24 heures élevée et un faible volume urinaire (qui augmente la concentration d'acide urique urinaire) ;
ces lithiases sont favorisées par un pH urinaire bas, une uricurie des 24 heures élevée et un faible volume urinaire (qui augmente la concentration d'acide urique urinaire) ;
–  la néphropathie uratique est devenue rare en France mais elle est sans doute méconnue et peut s'observer dans des gouttes non traitées, souvent sévères et négligées. Elle se traduit par des dépôts d'urates dans la médulla rénale, bien visibles à l'échographie rénale avec doppler. Elle est source d'insuffisance rénale chronique (IRC), aggravée par les AINS le cas échéant.
la néphropathie uratique est devenue rare en France mais elle est sans doute méconnue et peut s'observer dans des gouttes non traitées, souvent sévères et négligées. Elle se traduit par des dépôts d'urates dans la médulla rénale, bien visibles à l'échographie rénale avec doppler. Elle est source d'insuffisance rénale chronique (IRC), aggravée par les AINS le cas échéant.
2.1.4 - Diagnostic
Le diagnostic de la goutte repose sur :
- le terrain : homme de plus de 35 ans, femme ménopausée, traitement par diurétiques au long cours, transplantés d'organe ; le contexte familial doit être recherché car la goutte a une forte composante génétique (maladie polygénique habituellement, rares mutations dans des gouttes juvéniles) ;
- certains écarts nutritionnels mettant en avant les interactions gènes-environnement : excès de boissons sucrées riches en fructose (sodas même « sans sucre »), consommation de bières avec ou sans alcool (riches en guanine), alcools forts (whisky, cognac, etc.), alimentation trop calorique (excès de boissons alcoolisées en général) et riche en protéines animales ;
- l'anamnèse (crises de goutte antérieures, antécédents familiaux de goutte, antécédents de lithiase urique) ; dans un accès goutteux, des facteurs déclenchants sont à rechercher : traumatisme, contexte postopératoire, infarctus ou infection à distance, prise médicamenteuse (mise en route d'un hypo-uricémiant), absorption de certaines boissons ou aliments déclenchant l'accès goutteux chez un goutteux donné ;
- les caractéristiques de la crise (début brutal, maximum des symptômes en 24 heures, gonflement et rougeur locale, localisation à la MTP du gros orteil, résolution spontanée qui sera raccourcie par les traitements anti-inflammatoires) ;
- leur sensibilité rapide à la colchicine (débutée tôt) ;
- la présence de tophus visibles et/ou palpables cliniquement ;
- l'uricémie qui est le plus souvent trouvée supérieure à 360 μmol/l (60 mg/l) mais qui peut être normale lors des accès
 (il faut répéter le dosage une quinzaine de jours après l'accès goutteux, ce qui permet d'avoir une uricémie « basale » avant le début du traitement hypo-uricémiant) ;
(il faut répéter le dosage une quinzaine de jours après l'accès goutteux, ce qui permet d'avoir une uricémie « basale » avant le début du traitement hypo-uricémiant) ; - la mise en évidence de microcristaux d'UMS dans le liquide articulaire ou dans un tophus clinique : c'est l'examen le plus contributif au diagnostic car pathognomonique

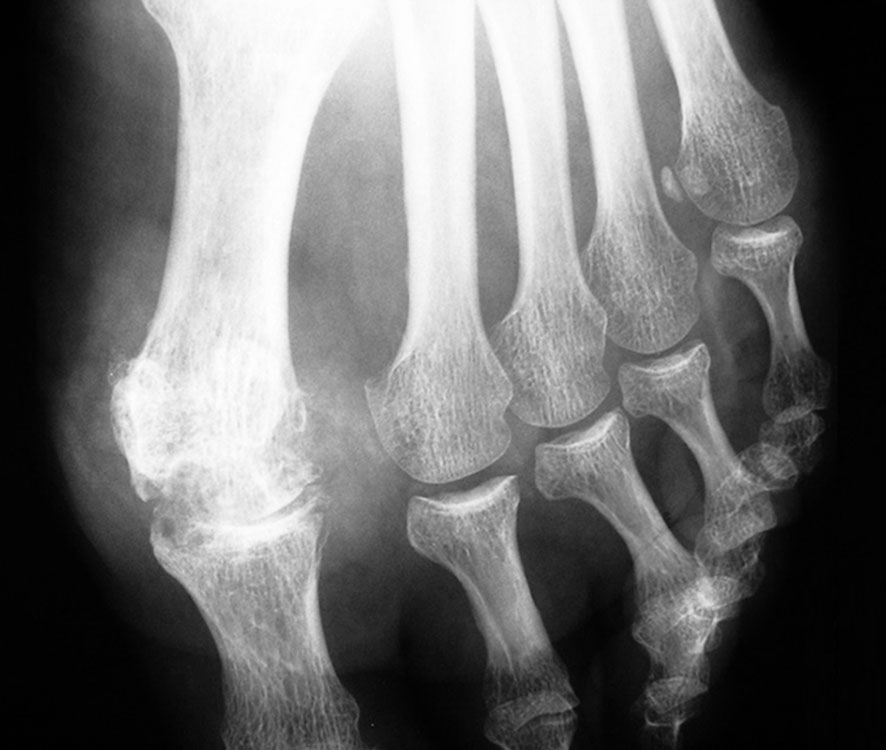
- la radiographie articulaire ne montre que très tardivement l'aspect d'arthropathie uratique, faite de géodes ou d'encoches épiphysaires, avec conservation prolongée de l'interligne articulaire et ostéophytose marginale (fig. 19.3). Elle a un intérêt dans le diagnostic différentiel avec la « pseudo-goutte » (chondrocalcinose articulaire), une arthrite infectieuse, etc. ;
Fig. 19-3 : Arthropathie uratique de l'articulation métatarsophalangienne de l'hallux (radiographie).
Arthropathie uratique de l'articulation métatarsophalangienne de l'hallux (radiographie).
- l'échographie articulaire, avec doppler couleur, peut être très utile si elle montre un aspect en « double contour » (fig. 19.4 ; il correspond aux dépôts uratiques présents à la surface du cartilage) ou pour déceler des tophus goutteux (fig. 19.5) non visibles à l'examen clinique ou à la radiographie. Le doppler montrera la vascularisation plus intense en rapport avec la composante vasculaire de la réaction inflammatoire locale.
Fig. 19-4 : Aspects échographiques dits « en double contour » à la surface du cartilage (dépôts de cristaux d'urate).
Aspects échographiques dits « en double contour » à la surface du cartilage (dépôts de cristaux d'urate).
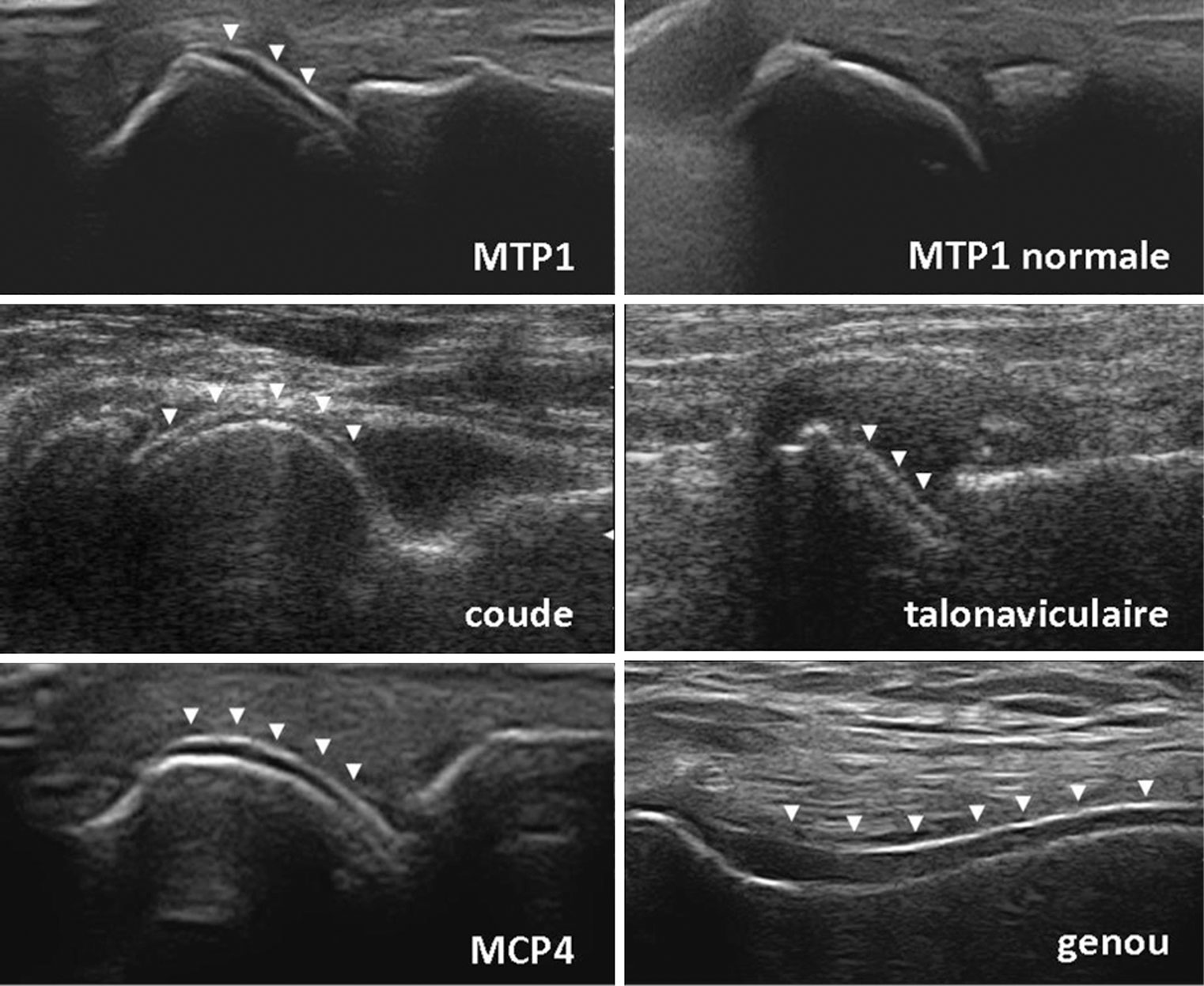
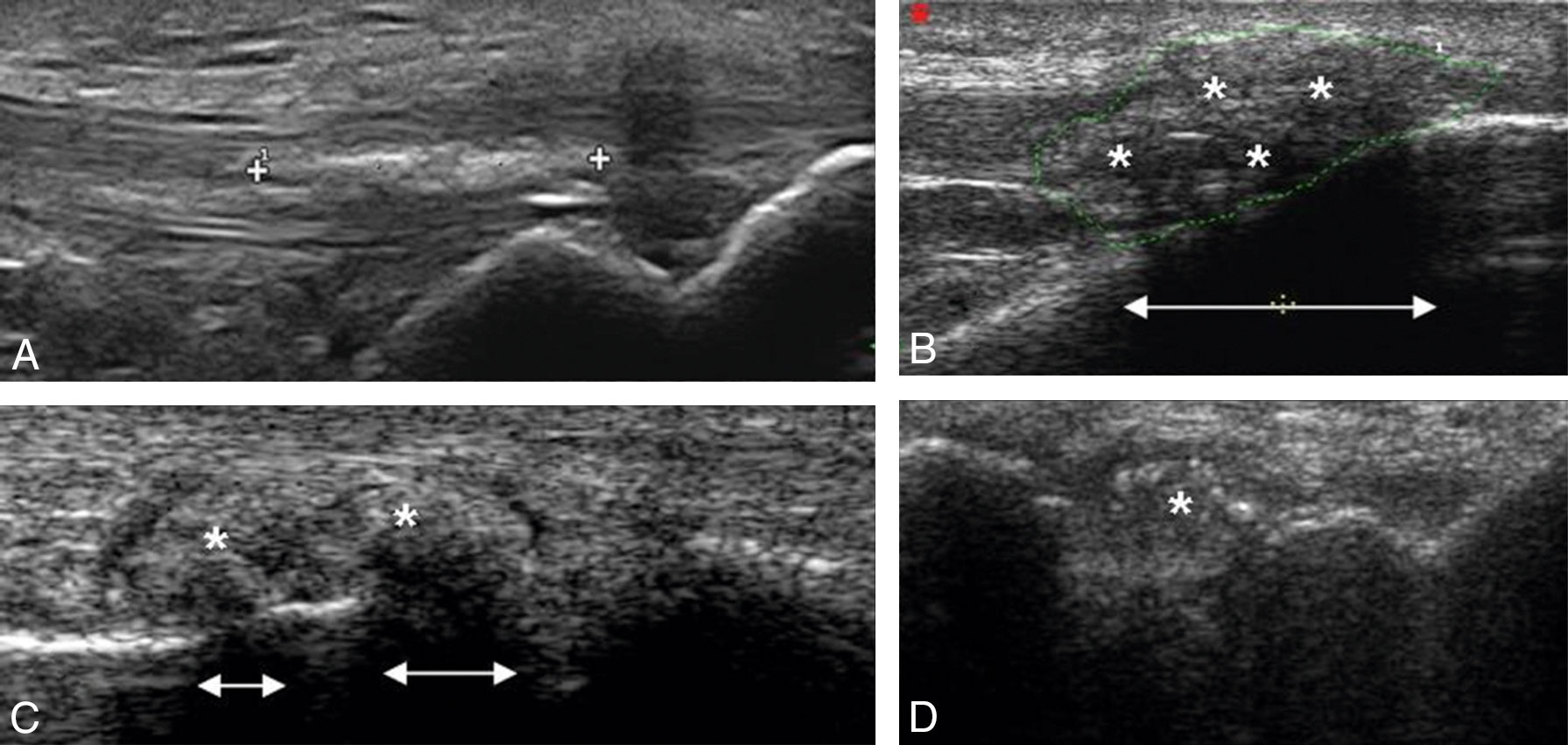
Fig. 19-5 : Différents aspects échographiques de tophus goutteux.
Différents aspects échographiques de tophus goutteux.
A. Tophus fusiforme hyperéchogène du tendon rotulien. B. Tophus (astérisque) isoéchogène du tendon rotulien à son insertion distale avec atténuation des ultrasons (double flèche). C. Tophus de la 1re MTP avec un aspect de masse isoéchogène (astérisque) associé à une atténuation postérieure (double flèche) et un halo hypoéchogène péritophacé. D. Tophus (astérisque) intra-articulaire du poignet avec spots hyperéchogènes intratophacés évocateurs.
2.2 - Rhumatisme à pyrophosphate de calcium (anciennement appelée chondrocalcinose)
2.2.1 - Notions générales
 Le rhumatisme à pyrophosphate de calcium (PPC) est caractérisé par le dépôt dans les tissus articulaires (cartilage hyalin et fibrocartilage surtout) de cristaux de PPC.
Le rhumatisme à pyrophosphate de calcium (PPC) est caractérisé par le dépôt dans les tissus articulaires (cartilage hyalin et fibrocartilage surtout) de cristaux de PPC.
 Sa prévalence augmente avec l'âge : 10 à 15 % entre 65 et 75 ans, plus de 30 % au-delà. La prédominance féminine diminue avec l'âge.
Sa prévalence augmente avec l'âge : 10 à 15 % entre 65 et 75 ans, plus de 30 % au-delà. La prédominance féminine diminue avec l'âge.
Il peut être asymptomatique, de découverte radiographique  (alors appelée chondrocalcinose au sens strict).
(alors appelée chondrocalcinose au sens strict).
Contrairement à la goutte, on ne guérit pas de ce rhumatisme.
Il peut donner lieu à diverses manifestations articulaires (25 % des cas) :
- arthrite aiguë, en particulier au genou ou au poignet, mono- ou oligoarticulaire (voire polyarticulaire), volontiers récidivante ; le diagnostic est à évoquer chez un sujet âgé de plus de 60 ans ;
-
 ce tableau clinique d'arthrite aiguë peut s'accompagner d'un épanchement hémorragique (hémarthrose).
ce tableau clinique d'arthrite aiguë peut s'accompagner d'un épanchement hémorragique (hémarthrose). - monoarthropathie chronique à l'origine d'une arthrose secondaire évolutive, fréquente, pouvant intéresser la hanche ou le genou, ou surtout des articulations rarement touchées par l'arthrose primitive : poignet, cheville, coude, poignet, articulations métacarpophalangiennes (MCP) ;
- arthropathies destructrices rapides souvent multiples, touchant la femme âgée et caractérisées par une destruction de l'os sous-chondral. Elles peuvent être rapides, notamment à la hanche et à l'épaule ;
-
 polyarthrite chronique, rare, touchant de façon souvent additive et successive diverses articulations, ce qui peut, avec le temps, aboutir à une présentation globalement bilatérale et symétrique évoquant faussement une polyarthrite rhumatoïde avec pincement des interlignes articulaires ;
polyarthrite chronique, rare, touchant de façon souvent additive et successive diverses articulations, ce qui peut, avec le temps, aboutir à une présentation globalement bilatérale et symétrique évoquant faussement une polyarthrite rhumatoïde avec pincement des interlignes articulaires ; - atteintes rachidiennes : calcifications discales pouvant causer des accès aigus, discopathies destructrices, arthrite interapophysaire aiguë, qui peuvent mimer une rachialgie infectieuse ou tumorale.
2.2.2 - Diagnostic
 Le diagnostic repose sur :
Le diagnostic repose sur :
- la mise en évidence dans le liquide articulaire de cristaux de PPC
 (cf. supra) ;
(cf. supra) ; - les radiographies articulaires : mise en évidence des calcifications caractéristiques
 :
:
– dépôts dans l'épaisseur des cartilages articulaires, prenant la forme d'opacités linéaires restant à distance et parallèles à la limite de l'os sous-chondral (tête humérale, tête fémorale), moins souvent dans d'autres articulations ;
– dépôts fibrocartilagineux :
. aux genoux : dessinant par exemple les ménisques (méniscocalcose) sous la forme d'opacités triangulaires à base tournée vers l'extérieur de l'articulation ; ces calcifications sont présentes dans 90 % des cas (fig. 19.6) ;
. calcification aux poignets : ligament triangulaire du carpe (fig. 19.7) mais aussi calcifications des cartilages intracarpiens ;
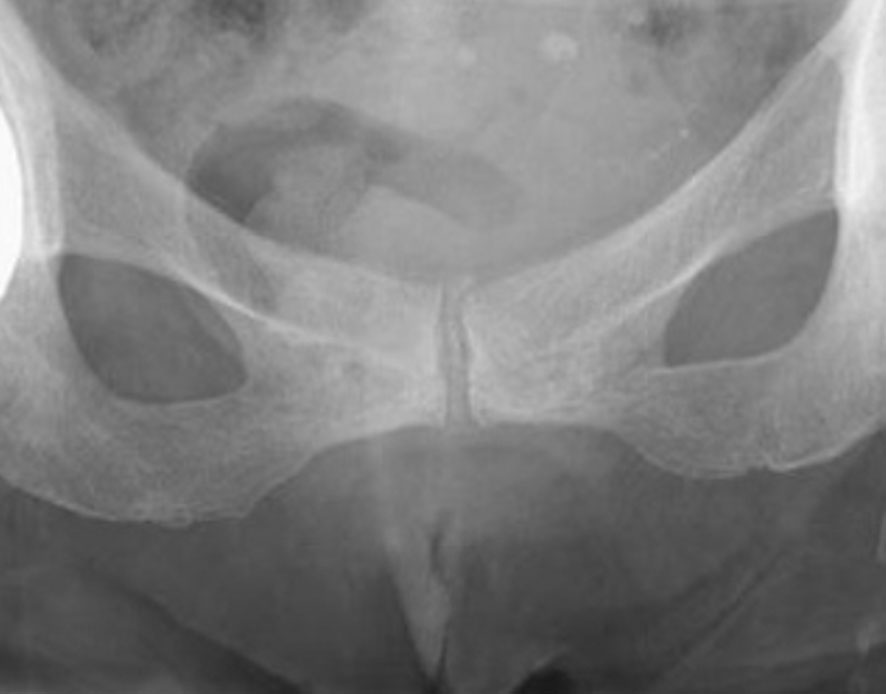
. calcification de la symphyse pubienne : calcification linéaire verticale (fig. 19.8).
Fig. 19-6 : Rhumatisme à PPC.
Rhumatisme à PPC.
Calcification des ménisques et opacités linéaires dans l'interligne articulaire fémorotibial (radiographie du genou de face).
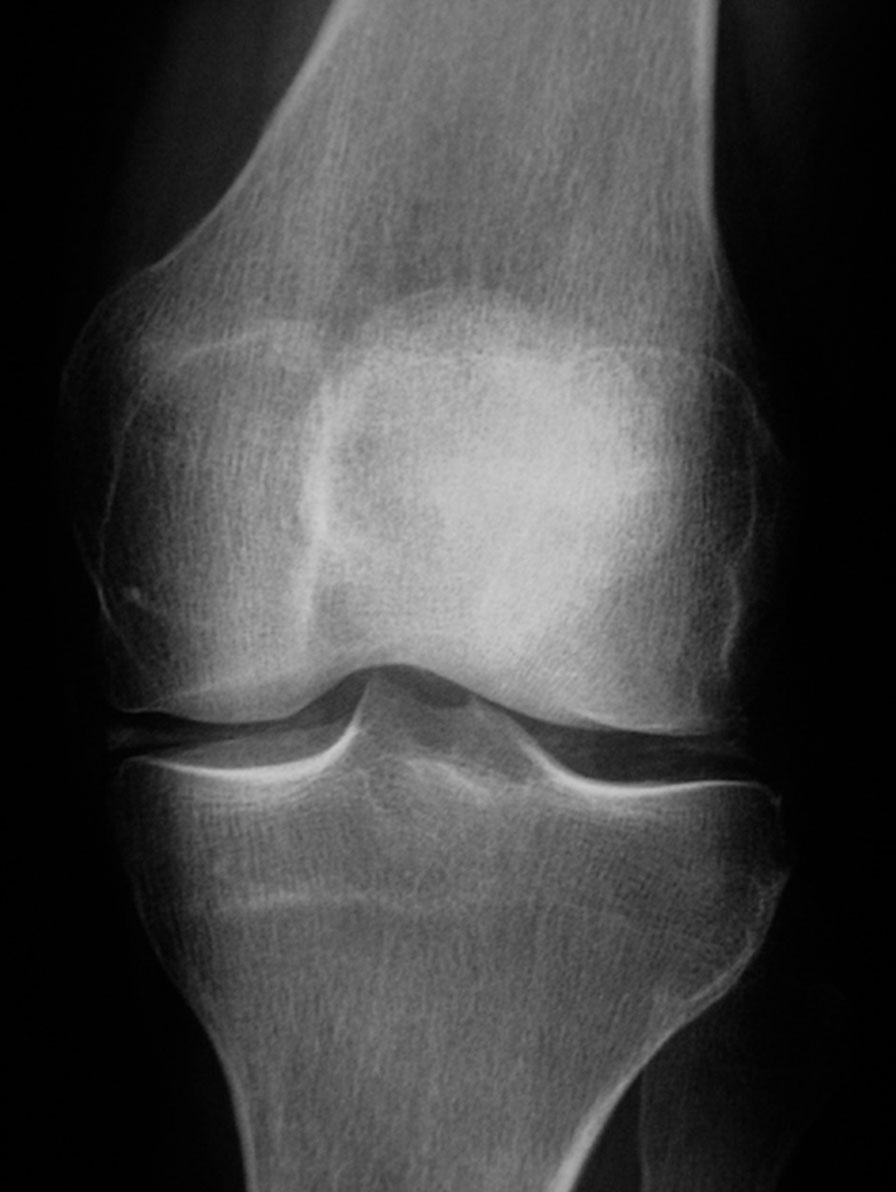
Fig. 19-7 : Rhumatisme à PPC.
Rhumatisme à PPC.
Calcifications du ligament triangulaire du carpe et de l'interligne articulaire scaphotrapézien (radiographie du poignet de face).
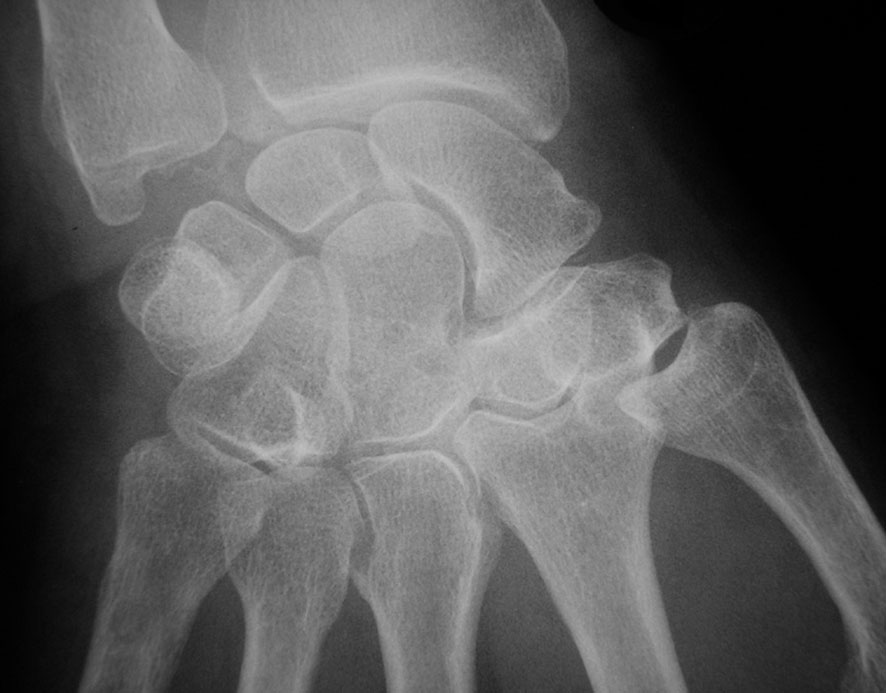
Fig. 19-8 : Rhumatisme à PPC.
Rhumatisme à PPC.
Calcification de la symphyse pubienne (radiographie du bassin de face).
Les
radiographies suivantes sont à prescrire en cas de suspicion de rhumatisme à PPC, ou en cas d'une première localisation pour préciser le caractère diffus des dépôts :
- les deux mains de face avec les poignets ;
- les deux genoux : face debout et en schuss, profils et défilés fémoropatellaires ;
- bassin debout de face.
Elles doivent toujours être bilaterales et comparatives : une arthrite d'un poignet à radiographie normale peut s'accompagner des dépôts calciques typiques sur la radiographie controlatérale.
 L'échographie articulaire : les dépôts de pyrophosphate de calcium peuvent apparaître sous la forme d'une fine bande ou de grains hyperéchogènes dans l'épaisseur du cartilage ou de points « scintillants » dans les fibrocartilages ou de calcifications méniscales hyperéchogènes.
L'échographie articulaire : les dépôts de pyrophosphate de calcium peuvent apparaître sous la forme d'une fine bande ou de grains hyperéchogènes dans l'épaisseur du cartilage ou de points « scintillants » dans les fibrocartilages ou de calcifications méniscales hyperéchogènes.
2.3 - Rhumatisme apatitique
2.3.1 - Notions générales
 Le rhumatisme apatitique est dû à des dépôts de cristaux de la famille des apatites (cristaux de phosphate de calcium présents naturellement dans l'os), essentiellement dans des structures péri-articulaires : tendons, capsules articulaires et bourses séreuses.
Le rhumatisme apatitique est dû à des dépôts de cristaux de la famille des apatites (cristaux de phosphate de calcium présents naturellement dans l'os), essentiellement dans des structures péri-articulaires : tendons, capsules articulaires et bourses séreuses.
 Ces dépôts calciques sont également observés dans les tissus sous-cutanés en situation ectopique comme les calcinoses du CREST et de la sclérodermie systémique, mais aussi des dermatomyosites et myosites auto-immunes.
Ces dépôts calciques sont également observés dans les tissus sous-cutanés en situation ectopique comme les calcinoses du CREST et de la sclérodermie systémique, mais aussi des dermatomyosites et myosites auto-immunes.
 Les dépôts qui peuvent être multiples — on parle alors de maladie des calcifications tendineuses multiples — siègent surtout à l'épaule (tendon du supra-épineux) et à la hanche (région trochantérienne ou para-acétabulaire). Ils peuvent aussi être présents au site d'insertion de n'importe quel tendon, ligament ou capsule.
Les dépôts qui peuvent être multiples — on parle alors de maladie des calcifications tendineuses multiples — siègent surtout à l'épaule (tendon du supra-épineux) et à la hanche (région trochantérienne ou para-acétabulaire). Ils peuvent aussi être présents au site d'insertion de n'importe quel tendon, ligament ou capsule.
Ils peuvent être asymptomatiques, de découverte radiologique, en particulier à l'épaule, ou causer une inflammation aiguë ou, plus rarement, chronique (cf. infra). Les crises douloureuses correspondent à une tentative de résorption aiguë spontanée avec migration calcique possible dans la bourse au contact du tendon ou en intra-osseux.
Les crises aiguës peuvent toucher n'importe quelle articulation, mais sont fréquentes à l'épaule.
Elles sont volontiers très douloureuses avec réveils nocturnes : l'exemple type est celui d'une épaule dite hyperalgique, intouchable, le patient se présentant dans l'attitude dite des « traumatisés du membre supérieur », le moindre mouvement déclenchant de vives douleurs. Il peut y avoir de la fièvre et la ponction articulaire doit être faite au moindre doute d'arthrite septique.
 Les calcifications peuvent aussi causer des douleurs chroniques, à l'épaule surtout. Lorsque, devant une épaule douloureuse chronique, on met en évidence une calcification du supra-épineux sans signe de rupture de coiffe, on peut proposer, après avis d'un spécialiste rhumatologue, si la douleur résiste aux traitements usuels, de retirer la calcification causale par ponction-aspiration radioguidée ou sous arthroscopie. La fragmentation par ondes de choc (lithotritie) est proposée dans certaines indications.
Les calcifications peuvent aussi causer des douleurs chroniques, à l'épaule surtout. Lorsque, devant une épaule douloureuse chronique, on met en évidence une calcification du supra-épineux sans signe de rupture de coiffe, on peut proposer, après avis d'un spécialiste rhumatologue, si la douleur résiste aux traitements usuels, de retirer la calcification causale par ponction-aspiration radioguidée ou sous arthroscopie. La fragmentation par ondes de choc (lithotritie) est proposée dans certaines indications.
2.3.2 - Diagnostic
 Le diagnostic peut être fait par l'anamnèse, les crises étant volontiers récidivantes et le patient se sachant souvent porteur de calcifications tendineuses, surtout par les radiographies standards (cf. chapitre 30), qui montrent l'opacité calcique dans le tendon du supra-épineux ou dans la bourse sous-acromio-deltoïdienne.
Le diagnostic peut être fait par l'anamnèse, les crises étant volontiers récidivantes et le patient se sachant souvent porteur de calcifications tendineuses, surtout par les radiographies standards (cf. chapitre 30), qui montrent l'opacité calcique dans le tendon du supra-épineux ou dans la bourse sous-acromio-deltoïdienne.
La calcification apatitique est arrondie, homogène, sans corticale. Elle peut commencer à se résorber en devenant polylobée puis hétérogène.
La calcification peut se résorber complètement lors de la crise aiguë ; si les clichés sont faits tardivement, ils peuvent être normaux. Il faut alors radiographier l'épaule controlatérale ou les hanches à la recherche d'autres calcifications.
3 - Principales étiologies associées à la goutte et la chondrocalcinose
3.1 - Goutte
3.1.1 - Notions générales
 La goutte est la conséquence d'une hyperuricémie chronique (uricémie > 60 mg/l ou 360 μmol/l). L'hyperuricémie est une cause nécessaire mais non suffisante pour développer une maladie goutteuse.
La goutte est la conséquence d'une hyperuricémie chronique (uricémie > 60 mg/l ou 360 μmol/l). L'hyperuricémie est une cause nécessaire mais non suffisante pour développer une maladie goutteuse.
Seuls 10 à 15 % des sujets hyperuricémiques développent la goutte. Cela justifie actuellement de ne pas traiter une hyperuricémie asymptomatique.
Le risque de goutte augmente avec la durée et l'intensité de l'hyperuricémie mais même une uricémie à 100 mg/l ne s'accompagne de goutte que chez 50 % des sujets seulement après 15 ans de suivi.
Deux mécanismes principaux mènent à l'hyperuricémie :
- surtout un défaut d'élimination rénale et/ou intestinale ;
-
 un excès de production d'acide urique (rare).
un excès de production d'acide urique (rare).
 L'hyperuricémie est souvent expliquée (90 % des cas) par une augmentation trop faible de la clairance de l'acide urique en réponse à une augmentation de l'uricémie, lorsque les apports alimentaires de purines (dont la dégradation conduit à l'acide urique) augmentent.
L'hyperuricémie est souvent expliquée (90 % des cas) par une augmentation trop faible de la clairance de l'acide urique en réponse à une augmentation de l'uricémie, lorsque les apports alimentaires de purines (dont la dégradation conduit à l'acide urique) augmentent.
Les transporteurs d'acide urique ABCG2 dans l'intestin et du tubule rénal proximal qui assurent l'excrétion de l'acide urique sont inactifs ou moins actifs du fait des mutations de ce gène. À l'inverse, pour le transporteur URAT1 qui réabsorbe l'acide urique dans le tube contourné proximal, son activité est augmentée. Le résultat net est une diminution de l'élimination intestinale et rénale d'acide urique.
 Les facteurs de risque de goutte sont (en dehors de l'hyperuricémie) : l'âge, le sexe masculin, la ménopause, les antécédents familiaux de goutte, l'insuffisance rénale chronique, le syndrome métabolique, les habitudes alimentaires (régime hyperprotéique, boissons riches en fructose) et l'alcool (bières avec ou sans alcool, riches en purines, alcools forts, calories inutiles), certains médicaments (diurétiques de l'anse et thiazidiques, ciclosporine).
Les facteurs de risque de goutte sont (en dehors de l'hyperuricémie) : l'âge, le sexe masculin, la ménopause, les antécédents familiaux de goutte, l'insuffisance rénale chronique, le syndrome métabolique, les habitudes alimentaires (régime hyperprotéique, boissons riches en fructose) et l'alcool (bières avec ou sans alcool, riches en purines, alcools forts, calories inutiles), certains médicaments (diurétiques de l'anse et thiazidiques, ciclosporine).
3.1.2 - Causes de la goutte
Goutte primitive, ou génétique
La goutte est habituellement
primitive, familiale avec une prédominance masculine. Divers éléments du
syndrome métabolique sont fréquemment associés à la goutte : obésité avec augmentation du périmètre abdominal (> 94 cm chez l'homme européen et 88 cm chez la femme), hypertension artérielle, intolérance au glucose ou diabète sucré, dyslipidémie avec diminution du HDL-cholestérol et hypertriglycéridémie.
Les patients goutteux sont donc à considérer à fort risque d'événements cardiovasculaires, qui expliquent la surmortalité observée.
 Dans moins de 1 % des cas, la goutte est due à une enzymopathie dont la mieux connue est le déficit en hypoxanthine guanine phosphoribosyl transférase (HGPRT ou HPRT). Ce déficit donne, lorsqu'il est partiel, une goutte sévère, précoce et compliquée de lithiases rénales par hyperuricurie majeure et d'anomalies neurologiques diverses ; lorsqu'il est complet, s'y associe une encéphalopathie sévère (syndrome de Lesch et Nyhan).
Dans moins de 1 % des cas, la goutte est due à une enzymopathie dont la mieux connue est le déficit en hypoxanthine guanine phosphoribosyl transférase (HGPRT ou HPRT). Ce déficit donne, lorsqu'il est partiel, une goutte sévère, précoce et compliquée de lithiases rénales par hyperuricurie majeure et d'anomalies neurologiques diverses ; lorsqu'il est complet, s'y associe une encéphalopathie sévère (syndrome de Lesch et Nyhan).
Des gouttes de survenue précoce, avant 35 ans, sont possibles chez 10 à 15 % des patients goutteux. Elles sont d'origine génétique avec des anomalies des gènes codant des transporteurs d'acide urique dans les tubules rénaux (URAT1, ABCG2).
Parfois, il s'agit de mutations de gènes codant d'autres transporteurs, toutes associées à des néphropathies tubulo-insterstitielles familiales avec kystes rénaux, HTA, insuffisance rénale sévère, hyperuricémie et goutte pour UMOD. L'histoire familiale, hommes et femmes, n'est pas seulement celle d'une goutte mais surtout d'une HTA, d'une insuffisance rénale fatale avant les techniques de dialyse et de greffe rénale.
Gouttes secondaires

La goutte peut être
secondaire à :
- une insuffisance rénale chronique, qui diminue l'excrétion d'acide urique ;
- la prise pendant plusieurs années d'un médicament réduisant l'excrétion urinaire d'acide urique et tout particulièrement les diurétiques thiazidiques, furosémide ou acide étacrynique, acétazolamide ;
-
 rarement une hémopathie chronique (polyglobulie, leucémies chroniques) qui augmente la dégradation des acides nucléiques des cellules tumorales en acide urique.
rarement une hémopathie chronique (polyglobulie, leucémies chroniques) qui augmente la dégradation des acides nucléiques des cellules tumorales en acide urique.
 L'interrogatoire recherchera systématiquement une prise de médicaments hyperuricémiants (brève durée de prescription) :
L'interrogatoire recherchera systématiquement une prise de médicaments hyperuricémiants (brève durée de prescription) :
- ciclosporine, tacrolimus, aspirine à faible dose ;
-
 certains antituberculeux (éthambutol et pyrazinamide) ;
certains antituberculeux (éthambutol et pyrazinamide) ; -
 certaines chimiothérapies.
certaines chimiothérapies.
 Le dosage de la créatininémie et le calcul du débit de filtration glomérulaire (DFGe, selon les formules MDRD ou CKD-EPI), une NFS-plaquettes sont nécessaires au bilan étiologique et au choix des médications.
Le dosage de la créatininémie et le calcul du débit de filtration glomérulaire (DFGe, selon les formules MDRD ou CKD-EPI), une NFS-plaquettes sont nécessaires au bilan étiologique et au choix des médications.
3.2 - Rhumatisme à cristaux de PPC (anciennement chondrocalcinose)
Forme primitive
Ce rhumatisme microcristallin est primitif dans la majorité des cas (aucune cause n'est mise en évidence).
Sa fréquence notamment sur son versant radiologique pur (chondrocalcinose) augmente avec l'âge.Des formes familiales, souvent diffuses et sévères, doivent être évoquées et recherchées devant une chondrocalcinose radiologique volontiers diffuse diagnostiquée chez un sujet âgé de moins de 50 ans.
Formes secondaires : affections associées
 Les deux principales affections associées sont l'hémochromatose génétique et l'hyperparathyroïdie primitive. Le rhumatisme à PPC ou la chondrocalcinose radiologique peuvent amener à leur diagnostic : elles doivent être recherchées systématiquement par les dosages appropriés : fer sérique et coefficient de saturation de sidérophiline (> 45 %) et calcémie (voire dosage de PTHi). Leur traitement ne modifie pas l'évolution du rhumatisme à PPC.
Les deux principales affections associées sont l'hémochromatose génétique et l'hyperparathyroïdie primitive. Le rhumatisme à PPC ou la chondrocalcinose radiologique peuvent amener à leur diagnostic : elles doivent être recherchées systématiquement par les dosages appropriés : fer sérique et coefficient de saturation de sidérophiline (> 45 %) et calcémie (voire dosage de PTHi). Leur traitement ne modifie pas l'évolution du rhumatisme à PPC.
Il faut connaître le rhumatisme associé à l'hémochromatose génétique : chondrocalcinose associée à une arthropathie spécifique aux 2e et 3e articulations métacarpophalangiennes (MCP) (aspect de pincement articulaire avec microgéodes, condensation osseuse sous-chondrale, ostéophytose en « hameçon »). On peut être amené, si le coefficient de saturation est élevé (> 45 %), à rechercher une mutation homozygote du gène HFE (p.Cys282Tyr).
 Deux autres affections plus rares peuvent être recherchées : l'hypophosphatasie congénitale (phosphatases alcalines basses) et l'hypomagnésémie (syndrome de Gitelman avec magnésémie abaissée).
Deux autres affections plus rares peuvent être recherchées : l'hypophosphatasie congénitale (phosphatases alcalines basses) et l'hypomagnésémie (syndrome de Gitelman avec magnésémie abaissée).

Le traitement de la maladie associée ne change pas l'évolution du rhumatisme à cristaux de PPC.
4 - Traitement et suivi d'un rhumatisme microcristallin
4.1 - Goutte
 Cette maladie peut « guérir » moyennant un traitement visant à abaisser durablement le taux d'acide urique, et cela de façon permanente.
Cette maladie peut « guérir » moyennant un traitement visant à abaisser durablement le taux d'acide urique, et cela de façon permanente.
4.1.1 - Accès goutteux (selon les recommandations 2020 de la SFR)
 Quatre principes simples président à la prise en charge, fondée sur l'éducation du patient :
Quatre principes simples président à la prise en charge, fondée sur l'éducation du patient :
- le patient doit être informé de l'importance de traiter la crise de goutte dès ses premiers signes. Il doit pouvoir s'auto-traiter selon un traitement prédéfini, expliqué et prescrit par son médecin ;
- le patient doit savoir que le traitement de la crise ne suffit pas à traiter la goutte, et doit connaître l'importance du traitement hypo-uricémiant qui, seul, peut soulager définitivement les symptômes de la goutte ;
- le choix du traitement de la crise de goutte dépend :
– des comorbidités (maladies cardiovasculaires, insuffisance rénale définie par un DFG estimé < 60 ml/min, diabète, ulcère gastroduodénal, infections) ;
– des antécédents d'intolérance médicamenteuse ;
– des interactions médicamenteuses potentielles ;
– du nombre et du type d'articulations touchées ; - les médicaments qui peuvent être utilisés pour le traitement de la crise sont :
– la colchicine, les AINS per os, la corticothérapie orale ou intra-articulaire ;
–  et les inhibiteurs de l'IL-1.
et les inhibiteurs de l'IL-1.
 D'autres moyens peuvent être associés : repos (orthèse) et glaçage articulaire (avec protection cutanée, qui raccourcit la durée de l'accès), médicaments antalgiques.
D'autres moyens peuvent être associés : repos (orthèse) et glaçage articulaire (avec protection cutanée, qui raccourcit la durée de l'accès), médicaments antalgiques.
Quatre recommandations simples sont à mettre en œuvre.
Recommandation 1
La
colchicine doit être
initiée le plus tôt possible, idéalement dans les 12 premières heures, à la posologie suivante :
- 1 mg dès le début de la crise, suivi de ½ mg une heure plus tard soit 1,5 mg le 1er jour ;
- et poursuivie les jours suivants à 0,5 mg × 2–3 par jour en fonction de l'évolution.
Les comprimés de colchicine dosés à 1 mg sont sécables. Il faut dire au malade d'avoir les médicaments (colchicine, AINS) à portée de main : « dans la poche » ou « sur la table de nuit ».
La diarrhée est le premier signe de toxicité de la colchicine et doit faire diminuer ou arrêter le traitement. Les médications avec ralentisseur du transit sont donc déconseillées.
La posologie de la colchicine doit être diminuée chez l'insuffisant rénal et en cas de coprescription de médicaments qui interfèrent avec son métabolisme (macrolides, pristinamycine, statines, etc.).
 Des précautions d'emploi sont à observer en association avec les statines (majoration et potentialisation des effets indésirables musculaires).
Des précautions d'emploi sont à observer en association avec les statines (majoration et potentialisation des effets indésirables musculaires).
Recommandation 2

La
corticothérapie orale doit être prescrite
dès le début de la crise à la dose de 30 à 35 mg par jour (équivalent prednisone) pendant 3 à 5 jours. Elle est déconseillée en cas de diabète de type 2 ou d'hypertension artérielle déséquilibrés.
 Le risque est l'automédication et ses conséquences. La tolérance est globalement meilleure que celle des AINS.
Le risque est l'automédication et ses conséquences. La tolérance est globalement meilleure que celle des AINS.
La corticothérapie intra-articulaire doit être privilégiée pour le traitement d'une arthrite facilement accessible à un geste local.
Recommandation 3

Les
AINS doivent être prescrits
per os dès le début de la crise et sur une
courte période, le temps de la crise. Ils doivent être évités en cas d'insuffisance rénale stade de stade 3 à 5 ou de maladie cardiovasculaire sévère. En effet, les nombreuses comorbidités associées à la goutte sont autant de contre-indications aux AINS, qui sont donc très fréquentes dans cette population. Ils sont aussi contre-indiqués chez le transplanté rénal, chez la personne âgée ou tout malade sous médicament anticoagulant (AVK, NACO).
Le naproxène a le meilleur profil risque-efficacité en termes cardiovasculaires. Une durée de 3 à 5 jours est un maximum.
Recommandation 4
 Les inhibiteurs de l'IL-1 doivent être initiés en milieu hospitalier et réservés aux cas d'échec, de contre-indication ou d'intolérance aux AINS, aux corticostéroïdes et à la colchicine. Ils sont contre-indiqués en cas d'infection et doivent faire surveiller les polynucléaires neutrophiles.
Les inhibiteurs de l'IL-1 doivent être initiés en milieu hospitalier et réservés aux cas d'échec, de contre-indication ou d'intolérance aux AINS, aux corticostéroïdes et à la colchicine. Ils sont contre-indiqués en cas d'infection et doivent faire surveiller les polynucléaires neutrophiles.
Ces malades difficiles à traiter sont identifiés par le rhumatologue et doivent bénéficier d'un bilan préthérapeutique, infectieux notamment. Deux agents anti-IL-1 (l'IL-1 est la cytokine clé de l'inflammation goutteuse) sont disponibles, l'anakinra ou antagoniste du récepteur à l'IL-1, et le canakinumab, anticorps monoclonal anti-IL-1β.
 Le premier n'a pas d'AMM mais a l'avantage d'être indiqué dans la PR ; il a une demi-vie courte et est peu onéreux. Le second a l'AMM pour la « crise de goutte difficile à traiter », a une demi-vie longue d'où son utilisation à raison d'une injection SC tous les 3 mois et son coût est élevé. Le canakinumab doit être administré à l'hôpital.
Le premier n'a pas d'AMM mais a l'avantage d'être indiqué dans la PR ; il a une demi-vie courte et est peu onéreux. Le second a l'AMM pour la « crise de goutte difficile à traiter », a une demi-vie longue d'où son utilisation à raison d'une injection SC tous les 3 mois et son coût est élevé. Le canakinumab doit être administré à l'hôpital.
4.1.2 - Traitement hypo-uricémiant (uniquement dans le cas d'une goutte) (selon les recommandations 2020 de la SFR)

Deuxième versant du traitement de la goutte est le traitement hypo-uricémiant (THU)

, qui amène à la désagrégation et donc au déstockage des microcristaux ; à moyen terme, les accès aigus qui gênent le malade disparaissent, les destructions osseuses se comblent en partie et le risque cardiovasculaire et rénal est réduit.
La mortalité cardiovasculaire est diminuée de 50 % à 15 ans chez les malades sous THU avec une uricémie à la
cible.
Trois principes sont à prendre en compte par le médecin (et le patient) :
- on retrouve l'information et l'éducation du patient qui sont essentielles au succès du traitement de fond de la goutte ;
- le patient goutteux doit savoir que les crises de goutte sont l'expression de dépôts chroniques de cristaux d'urate. Le but du traitement est l'abaissement permanent de l'uricémie afin d'obtenir la dissolution de ces dépôts, la disparition des signes cliniques et la prévention des complications chroniques de la goutte ;
- il faut que le médecin prenne le temps d'informer le patient sur :
– l'importance d'obtenir une valeur cible d'uricémie qui permette la dissolution des cristaux ;
– l'importance de l'adhésion au long cours aux traitements hypo-uricémiants ;
– le risque de crise de goutte à l'instauration des médicaments hypo-uricémiants ;
– le risque cardiovasculaire, métabolique et rénal associé à la goutte ;
– les adaptations nécessaires du mode de vie (éviter alcools et sodas sucrés, encourager l'activité physique et réduction pondérale).
Cinq recommandations sont à mettre en œuvre pour éviter l'inertie clinique, assurer un «
treat to target ».
Deux examens sont indispensables avant de débuter le THU : uricémie et débit de filtration glomérulaire estimé (DFGe). Le DFGe doit être mesuré par les formules MDRD ou CKE-EPI.
Recommandation 1
Un traitement hypo-uricémiant (THU) permanent est indiqué dès que le diagnostic de goutte est retenu. Cela veut dire que le THU peut être proposé dès la première crise de goutte, une fois diagnostiquée.
Recommandation 2
L'uricémie doit être abaissée à moins de 360 μmol/l (60 mg/l) et si possible à moins de 300 μmol/l (50 mg/l), chez tous les goutteux. Une fois la cible atteinte, le traitement doit être maintenu, et l'uricémie doit être contrôlée une à deux fois par an.
Recommandation 3
Le choix du THU dépend de la
fonction rénale qu'il convient de mesurer ; l'estimation du débit de filtration glomérulaire est obtenue par les formules MDRD ou CKD-EPI.
 L'allopurinol existe sous forme de comprimés sécables dosés à 100, 200 et 300 mg. Le fébuxostat existe sous forme de comprimés dosés à 80 et 120 mg mais n'est pas sécable ; il faut utiliser un couteau ou une guillotine à comprimés pour le segmenter en deux pour permettre des paliers de 40 mg. Cela permet une augmentation progressive mais soutenue des doses.
L'allopurinol existe sous forme de comprimés sécables dosés à 100, 200 et 300 mg. Le fébuxostat existe sous forme de comprimés dosés à 80 et 120 mg mais n'est pas sécable ; il faut utiliser un couteau ou une guillotine à comprimés pour le segmenter en deux pour permettre des paliers de 40 mg. Cela permet une augmentation progressive mais soutenue des doses.
- Lorsque le débit de filtration glomérulaire estimé (DFGe) est supérieur à 60 ml/min/1,73 m2, l'hypo-uricémiant de première intention est l'allopurinol. Il doit être débuté à 50 à 100 mg par jour et sa posologie doit être augmentée par paliers de 50 à 100 mg toutes les 2 à 4 semaines jusqu'à obtention de l'uricémie cible.
- Lorsque le DFGe est compris entre 30 et 60 ml/min/1,73 m2, la prescription d'allopurinol doit être prudente et le fébuxostat est une alternative à considérer.
- Lorsque le DFGe est inférieur à 30 ml/min/1,73 m2, l'allopurinol ne doit pas être utilisé et le fébuxostat doit être privilégié.
- L'utilisation du fébuxostat doit être prudente en cas de maladie cardiovasculaire sévère (insuffisance coronarienne instable ou antécédent d'infarctus myocardique, insuffisance cardiaque).
Recommandation 4

Prévention des accès goutteux en début de THU.
Il faut prévenir le patient de la possibilité d'accès goutteux lors de l'abaissement de l'uricémie. Cela doit être rappelé régulièrement. De même c'est un moment pour rappeler le traitement de la crise aiguë : avoir la colchicine (ou l'AINS) dans la poche et
débuter dès le début de l'accès.
Il faut prévenir les crises induites à l'instauration du traitement hypo-uricémiant :
- en associant à la prescription initiale, en l'absence de contre-indication, 0,5 ou 1 mg par jour de colchicine pendant au moins 6 mois ;
- en augmentant progressivement les doses de THU (fig. 19.9).
Fig. 19-9 : Principe de la baisse lente de l'uricémie dans la prévention de crise de goutte modérée.
Principe de la baisse lente de l'uricémie dans la prévention de crise de goutte modérée.
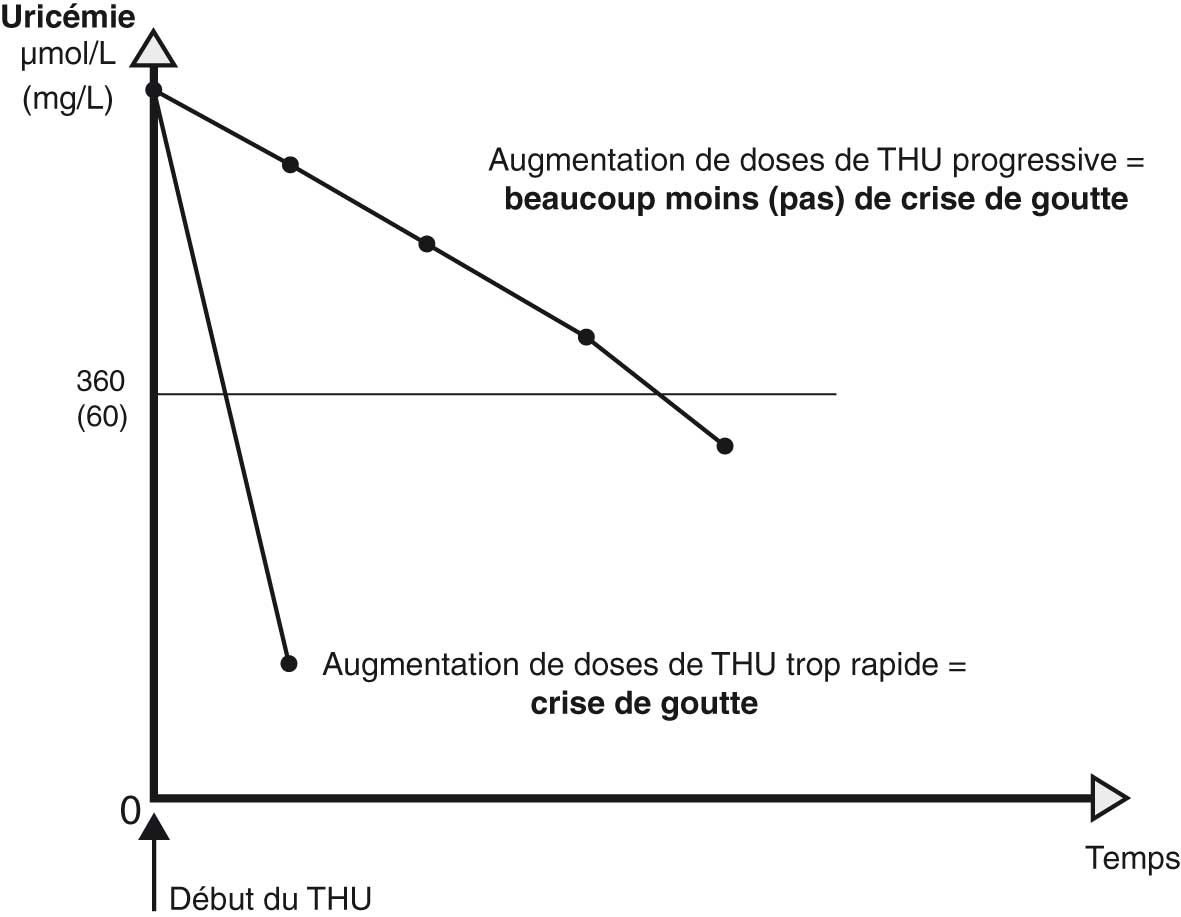
Une trop forte dose expose au déclenchement de crises et au risque de toxidermie. Une fois l'allopurinol ou le fébuxostat commencé, il ne faut jamais l'arrêter — même (et surtout) en cas de crise. Il faut faire accepter ce traitement à vie.
Recommandation 5
 Les maladies et facteurs de risque cardiovasculaire, le syndrome métabolique et l'insuffisance rénale doivent être dépistés et pris en charge. Ce point est important car les médecins généralistes voient les patients diabétiques hypertendus ou autre coronariens et doivent aussi prendre en charge leur maladie goutteuse.
Les maladies et facteurs de risque cardiovasculaire, le syndrome métabolique et l'insuffisance rénale doivent être dépistés et pris en charge. Ce point est important car les médecins généralistes voient les patients diabétiques hypertendus ou autre coronariens et doivent aussi prendre en charge leur maladie goutteuse.
Points importants à connaître pour les THU
Allopurinol

C'est un inhibiteur de la xanthine oxydase. La tolérance à l'allopurinol est habituellement bonne en particulier au long cours. Toutefois, dans les
trois premiers mois de prescription, des
réactions allergiques cutanées (éruption même mineure, ou survenue rare mais grave d'hypersensibilité médicamenteuse à type de toxidermie, de syndrome de Lyell ou de DRESS,
Drug Reaction with Eosinophilia and Systemic Symptoms) peuvent survenir. L'augmentation progressive des doses permet de les éviter.
 Elles sont plus fréquentes chez les sujets d'origine asiatique (Chinois Han en particulier, Thaïlandais), porteurs du gène HLA-B58*01, et d'origine africaine.
Elles sont plus fréquentes chez les sujets d'origine asiatique (Chinois Han en particulier, Thaïlandais), porteurs du gène HLA-B58*01, et d'origine africaine.

Ces éruptions, même minimes, imposent l'arrêt immédiat du médicament car l'issue peut être fatale et un avis médical doit être pris (à enseigner au patient) couplé au contrôle de la NFS, du DFGe et des tests hépatiques. La reprise du traitement est formellement contre-indiquée. Il faut savoir demander au patient s'il a fait dans le passé une allergie cutanée au Zyloric®, dénomination commerciale de l'allopurinol en DCI.
Fébuxostat
C'est un puissant inhibiteur de la xanthine oxydase, mais non purinique. Il ne nécessite pas d'adaptation posologique tant que le DFGe reste > 30 ml/min. Il faut éviter le fébuxostat en cas d'insuffisance cardiaque d'origine coronarienne. Des réactions allergiques croisées avec celles de l'allopurinol sont possibles : l'avis du spécialiste est indispensable.
Doivent être surveillés : les tests hépatiques, la fonction thyroïdienne. Les effets indésirables les plus fréquents sont des troubles digestifs dépendants de la dose (nausées, dyspepsie, diarrhée, constipation), des céphalées, des anomalies des tests hépatiques.
Cas de l'hyperuricémie asymptomatique
Une hyperuricémie isolée n'est pas une indication à un traitement pharmacologique mais à des mesures diététiques et d'ajustement médicamenteux 
. Il faut ainsi
remplacer le traitement diurétique antihypertenseur par du losartan ou de l'amlodipine, seuls antihypertenseurs à effet uricosurique.
L'arrêt des bières et sodas sucrés s'impose aussi.
Une hyperuricémie doit faire rechercher des maladies métaboliques (diabète sucré) et cardiaques associées (HTA, angor, etc.).
Éducation à la maladie
 Elle est adaptée au niveau socioculturel du patient dans le choix des termes. Elle doit viser à déculpabiliser le patient et à le débarrasser des images d'Épinal véhiculées dans la goutte : maladie des gros mangeurs et buveurs.
Elle est adaptée au niveau socioculturel du patient dans le choix des termes. Elle doit viser à déculpabiliser le patient et à le débarrasser des images d'Épinal véhiculées dans la goutte : maladie des gros mangeurs et buveurs.
Au contraire, il faut prendre le temps d'expliquer qu'il s'agit d'une maladie génétique dont témoignent les cas familiaux, résultant d'un défaut d'élimination de l'acide urique par les reins. L'acide urique en excès s'accumule et donne formation aux microcristaux stockés dans et autour des articulations voire sous la peau (tophus des hélix des oreilles). On explique alors que le phénomène est totalement réversible avec un traitement abaissant l'uricémie de façon permanente (annonce d'une maladie chronique)  .
.
Le traitement hypo-uricémiant (qui abaisse l'uricémie/acide urique) est commencé à posologie progressive et par paliers, sans urgence mais sans arrêt d'ajustement de la posologie à la hausse (risque d'inertie clinique) jusqu'à une cible thérapeutique : uricémie < 50 mg/l ou 300 μmol/l. Cette notion de cible est bien connue dans l'HTA (pression artérielle) et le diabète (taux d'HbA1c) traités.
Une fois la cible atteinte après quelques mois (dosages couplés de l'uricémie et de la créatininémie/DFGe), le traitement est maintenu à la dose active. Uricémie et DFGe seront alors vérifiés tous les 6 mois.
Mesures hygiéno-diététiques

Amaigrissement progressif en cas d'obésité ou de surcharge pondérale.
Diminution des boissons alcoolisées. Interdiction des spiritueux et de la bière (très riche en purines même lorsqu'elle est sans alcool) et arrêt des sodas sucrés et diminution des jus de fruits riches en fructose. La consommation de laitage écrémé doit être encouragée (effet uricosurique).« Frein sur les ABS » : Alcools forts, Bières, Sodas sucrés sont interdits.
- Modération de la consommation de viande et de produits de la mer.
- Les facteurs de risque de goutte et les comorbidités (cardiovasculaires, rénaux, syndrome métabolique) sont à dépister et traiter systématiquement.
- Un éventuel traitement diurétique favorisant sera, si c'est possible (HTA), stoppé.
4.2 - Rhumatisme à cristaux de PPC
Les accès aigus à cristaux de PPC peuvent être traités de la même façon que les accès goutteux. Toutefois, l'âge plus élevé des patients, les comorbidités souvent plus nombreuses et sévères, les médicaments associés et le risque d'interactions doivent rendre encore plus prudent dans l'emploi des AINS et de la colchicine. Il faut adapter les posologies à l'âge.
- Pour la colchicine : le même protocole que pour la goutte s'applique, voire moins et espacement en cas d'insuffisance rénale.
- Pour les AINS : il faut les éviter ou les réduire en dose et en durée la plus courte possible.
- Une infiltration de cortisonique, sous réserve d'avoir exclu une infection associée par l'examen du liquide synovial, est une solution simple en cas de monoarthrite.
-
 Les anti-IL-1 peuvent être utilisés.
Les anti-IL-1 peuvent être utilisés.
4.3 - Tendinopathie calcifiante ou inflammation péri-articulaire d'origine apatitique
 Le traitement comprend : repos, glaçage, AINS, voire corticothérapie orale (30 mg par jour) en cure courte de 3 à 5 jours. Les injections cortisoniques locales sont efficaces mais doivent être réalisées en seconde intention puisque l'évolution spontanée favorable est la règle.
Le traitement comprend : repos, glaçage, AINS, voire corticothérapie orale (30 mg par jour) en cure courte de 3 à 5 jours. Les injections cortisoniques locales sont efficaces mais doivent être réalisées en seconde intention puisque l'évolution spontanée favorable est la règle.
Quand envoyer au spécialiste rhumatologue
Un(e) patient(e) atteint(e) de goutte ?
- Toute goutte précoce débutant avant l'âge de 35 ans (avis de rhumatologues ou de néphrologues spécialisés : recherche de maladies génétiques ou rénales).
- Goutte polyarticulaire.
- Goutte tophacée ou avec dactylite goutteuse.
- Goutte en contexte d'insuffisance rénale chronique (DFGe < 60 ml/min).
- Goutte en contexte d'insuffisance cardiaque ou d'insuffisance coronaire instable.
- Goutte difficile à traiter (inefficacité, intolérance ou contre-indications à l'emploi de la colchicine, des AINS et de l'utilisation répétée des corticoïdes oraux ou IM).
- Antécédent d'allergie à l'allopurinol (Zyloric®) avant mise en route du fébuxostat.
Un(e) patient(e) atteint(e) de rhumatisme à PPC ?
- Rhumatisme de type chondrocalcinosique chez un sujet jeune (recherche de maladie associée) avant 50 ans.
- Atteinte polyarticulaire pseudorhumatoïde.
Un(e) patient(e) atteint(e) de calcifications tendineuses multiples ?
- Une épaule douloureuse chronique avec calcifications.
- Des accès inflammatoires récidivants sur calcifications multiples.
Légende :
Dans le respect de la Réforme du deuxième cycle des études médicales (R2C), les connaissances rassemblées sur ce site sont hiérarchisées en rang A, rang B et rang C à l'aide de balises et d'un code couleur :
 Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
 Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
 Connaissances spécifiques à un DES donné (troisième cycle).
Connaissances spécifiques à un DES donné (troisième cycle).
![]() Les rhumatismes microcristallins sont caractérisés par des dépôts intra-articulaires ou périarticulaires de microcristaux. Ces dépôts peuvent rester asymptomatiques ou être à l'origine d'accès inflammatoires aigus ou, parfois, d'arthropathies chroniques.
Les rhumatismes microcristallins sont caractérisés par des dépôts intra-articulaires ou périarticulaires de microcristaux. Ces dépôts peuvent rester asymptomatiques ou être à l'origine d'accès inflammatoires aigus ou, parfois, d'arthropathies chroniques.![]() .
.![]() .
.![]() .
.![]() .
.![]() La goutte est à la fois :
La goutte est à la fois :![]() moyennant un traitement visant à abaisser durablement le taux d'acide urique, et cela de façon permanente.
moyennant un traitement visant à abaisser durablement le taux d'acide urique, et cela de façon permanente.![]() .
.![]() Principe de formation de cristaus d'urate ou d'acide urique soluble selon l'uricémie.
Principe de formation de cristaus d'urate ou d'acide urique soluble selon l'uricémie.
![]() La goutte peut donner lieu aux manifestations suivantes :
La goutte peut donner lieu aux manifestations suivantes :![]() Tophus goutteux du pavillon de l'oreille droite.
Tophus goutteux du pavillon de l'oreille droite.
![]() Arthropathie uratique de l'articulation métatarsophalangienne de l'hallux (radiographie).
Arthropathie uratique de l'articulation métatarsophalangienne de l'hallux (radiographie).
![]() Aspects échographiques dits « en double contour » à la surface du cartilage (dépôts de cristaux d'urate).
Aspects échographiques dits « en double contour » à la surface du cartilage (dépôts de cristaux d'urate).
![]() Différents aspects échographiques de tophus goutteux.
Différents aspects échographiques de tophus goutteux.
![]() Le rhumatisme à pyrophosphate de calcium (PPC) est caractérisé par le dépôt dans les tissus articulaires (cartilage hyalin et fibrocartilage surtout) de cristaux de PPC.
Le rhumatisme à pyrophosphate de calcium (PPC) est caractérisé par le dépôt dans les tissus articulaires (cartilage hyalin et fibrocartilage surtout) de cristaux de PPC.![]() Sa prévalence augmente avec l'âge : 10 à 15 % entre 65 et 75 ans, plus de 30 % au-delà. La prédominance féminine diminue avec l'âge.
Sa prévalence augmente avec l'âge : 10 à 15 % entre 65 et 75 ans, plus de 30 % au-delà. La prédominance féminine diminue avec l'âge.![]() (alors appelée chondrocalcinose au sens strict).
(alors appelée chondrocalcinose au sens strict).![]() Le diagnostic repose sur :
Le diagnostic repose sur :![]() Rhumatisme à PPC.
Rhumatisme à PPC.
![]() Rhumatisme à PPC.
Rhumatisme à PPC.
![]() Rhumatisme à PPC.
Rhumatisme à PPC.
![]() L'échographie articulaire : les dépôts de pyrophosphate de calcium peuvent apparaître sous la forme d'une fine bande ou de grains hyperéchogènes dans l'épaisseur du cartilage ou de points « scintillants » dans les fibrocartilages ou de calcifications méniscales hyperéchogènes.
L'échographie articulaire : les dépôts de pyrophosphate de calcium peuvent apparaître sous la forme d'une fine bande ou de grains hyperéchogènes dans l'épaisseur du cartilage ou de points « scintillants » dans les fibrocartilages ou de calcifications méniscales hyperéchogènes.![]() Le rhumatisme apatitique est dû à des dépôts de cristaux de la famille des apatites (cristaux de phosphate de calcium présents naturellement dans l'os), essentiellement dans des structures péri-articulaires : tendons, capsules articulaires et bourses séreuses.
Le rhumatisme apatitique est dû à des dépôts de cristaux de la famille des apatites (cristaux de phosphate de calcium présents naturellement dans l'os), essentiellement dans des structures péri-articulaires : tendons, capsules articulaires et bourses séreuses.![]() Ces dépôts calciques sont également observés dans les tissus sous-cutanés en situation ectopique comme les calcinoses du CREST et de la sclérodermie systémique, mais aussi des dermatomyosites et myosites auto-immunes.
Ces dépôts calciques sont également observés dans les tissus sous-cutanés en situation ectopique comme les calcinoses du CREST et de la sclérodermie systémique, mais aussi des dermatomyosites et myosites auto-immunes.![]() Les dépôts qui peuvent être multiples — on parle alors de maladie des calcifications tendineuses multiples — siègent surtout à l'épaule (tendon du supra-épineux) et à la hanche (région trochantérienne ou para-acétabulaire). Ils peuvent aussi être présents au site d'insertion de n'importe quel tendon, ligament ou capsule.
Les dépôts qui peuvent être multiples — on parle alors de maladie des calcifications tendineuses multiples — siègent surtout à l'épaule (tendon du supra-épineux) et à la hanche (région trochantérienne ou para-acétabulaire). Ils peuvent aussi être présents au site d'insertion de n'importe quel tendon, ligament ou capsule.![]() Les calcifications peuvent aussi causer des douleurs chroniques, à l'épaule surtout. Lorsque, devant une épaule douloureuse chronique, on met en évidence une calcification du supra-épineux sans signe de rupture de coiffe, on peut proposer, après avis d'un spécialiste rhumatologue, si la douleur résiste aux traitements usuels, de retirer la calcification causale par ponction-aspiration radioguidée ou sous arthroscopie. La fragmentation par ondes de choc (lithotritie) est proposée dans certaines indications.
Les calcifications peuvent aussi causer des douleurs chroniques, à l'épaule surtout. Lorsque, devant une épaule douloureuse chronique, on met en évidence une calcification du supra-épineux sans signe de rupture de coiffe, on peut proposer, après avis d'un spécialiste rhumatologue, si la douleur résiste aux traitements usuels, de retirer la calcification causale par ponction-aspiration radioguidée ou sous arthroscopie. La fragmentation par ondes de choc (lithotritie) est proposée dans certaines indications.![]() Le diagnostic peut être fait par l'anamnèse, les crises étant volontiers récidivantes et le patient se sachant souvent porteur de calcifications tendineuses, surtout par les radiographies standards (cf. chapitre 30), qui montrent l'opacité calcique dans le tendon du supra-épineux ou dans la bourse sous-acromio-deltoïdienne.
Le diagnostic peut être fait par l'anamnèse, les crises étant volontiers récidivantes et le patient se sachant souvent porteur de calcifications tendineuses, surtout par les radiographies standards (cf. chapitre 30), qui montrent l'opacité calcique dans le tendon du supra-épineux ou dans la bourse sous-acromio-deltoïdienne.![]() La goutte est la conséquence d'une hyperuricémie chronique (uricémie > 60 mg/l ou 360 μmol/l). L'hyperuricémie est une cause nécessaire mais non suffisante pour développer une maladie goutteuse.
La goutte est la conséquence d'une hyperuricémie chronique (uricémie > 60 mg/l ou 360 μmol/l). L'hyperuricémie est une cause nécessaire mais non suffisante pour développer une maladie goutteuse.![]() L'hyperuricémie est souvent expliquée (90 % des cas) par une augmentation trop faible de la clairance de l'acide urique en réponse à une augmentation de l'uricémie, lorsque les apports alimentaires de purines (dont la dégradation conduit à l'acide urique) augmentent.
L'hyperuricémie est souvent expliquée (90 % des cas) par une augmentation trop faible de la clairance de l'acide urique en réponse à une augmentation de l'uricémie, lorsque les apports alimentaires de purines (dont la dégradation conduit à l'acide urique) augmentent.![]() Les facteurs de risque de goutte sont (en dehors de l'hyperuricémie) : l'âge, le sexe masculin, la ménopause, les antécédents familiaux de goutte, l'insuffisance rénale chronique, le syndrome métabolique, les habitudes alimentaires (régime hyperprotéique, boissons riches en fructose) et l'alcool (bières avec ou sans alcool, riches en purines, alcools forts, calories inutiles), certains médicaments (diurétiques de l'anse et thiazidiques, ciclosporine).
Les facteurs de risque de goutte sont (en dehors de l'hyperuricémie) : l'âge, le sexe masculin, la ménopause, les antécédents familiaux de goutte, l'insuffisance rénale chronique, le syndrome métabolique, les habitudes alimentaires (régime hyperprotéique, boissons riches en fructose) et l'alcool (bières avec ou sans alcool, riches en purines, alcools forts, calories inutiles), certains médicaments (diurétiques de l'anse et thiazidiques, ciclosporine).![]() L'interrogatoire recherchera systématiquement une prise de médicaments hyperuricémiants (brève durée de prescription) :
L'interrogatoire recherchera systématiquement une prise de médicaments hyperuricémiants (brève durée de prescription) :![]() Le dosage de la créatininémie et le calcul du débit de filtration glomérulaire (DFGe, selon les formules MDRD ou CKD-EPI), une NFS-plaquettes sont nécessaires au bilan étiologique et au choix des médications.
Le dosage de la créatininémie et le calcul du débit de filtration glomérulaire (DFGe, selon les formules MDRD ou CKD-EPI), une NFS-plaquettes sont nécessaires au bilan étiologique et au choix des médications.![]() Cette maladie peut « guérir » moyennant un traitement visant à abaisser durablement le taux d'acide urique, et cela de façon permanente.
Cette maladie peut « guérir » moyennant un traitement visant à abaisser durablement le taux d'acide urique, et cela de façon permanente.![]() Quatre principes simples président à la prise en charge, fondée sur l'éducation du patient :
Quatre principes simples président à la prise en charge, fondée sur l'éducation du patient :![]() D'autres moyens peuvent être associés : repos (orthèse) et glaçage articulaire (avec protection cutanée, qui raccourcit la durée de l'accès), médicaments antalgiques.
D'autres moyens peuvent être associés : repos (orthèse) et glaçage articulaire (avec protection cutanée, qui raccourcit la durée de l'accès), médicaments antalgiques.![]() Des précautions d'emploi sont à observer en association avec les statines (majoration et potentialisation des effets indésirables musculaires).
Des précautions d'emploi sont à observer en association avec les statines (majoration et potentialisation des effets indésirables musculaires).![]() Principe de la baisse lente de l'uricémie dans la prévention de crise de goutte modérée.
Principe de la baisse lente de l'uricémie dans la prévention de crise de goutte modérée.
![]() Le traitement comprend : repos, glaçage, AINS, voire corticothérapie orale (30 mg par jour) en cure courte de 3 à 5 jours. Les injections cortisoniques locales sont efficaces mais doivent être réalisées en seconde intention puisque l'évolution spontanée favorable est la règle.
Le traitement comprend : repos, glaçage, AINS, voire corticothérapie orale (30 mg par jour) en cure courte de 3 à 5 jours. Les injections cortisoniques locales sont efficaces mais doivent être réalisées en seconde intention puisque l'évolution spontanée favorable est la règle.![]() Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.![]() Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.![]() Connaissances spécifiques à un DES donné (troisième cycle).
Connaissances spécifiques à un DES donné (troisième cycle).