Polyarthrite rhumatoïde
![]() La PR est une maladie multifactorielle, de cause inconnue, impliquant :
La PR est une maladie multifactorielle, de cause inconnue, impliquant :
Ces facteurs contribuent à une réponse immunitaire innée et adaptative incontrôlée, se traduisant par la production d'autoanticorps au premier rang desquels le facteur rhumatoïde (FR) et les autoanticorps anti-protéines citrullinées (ACPA), ainsi que par une réaction inflammatoire concernant en premier lieu la membrane synoviale, dénommée synovite.
À terme, cette synovite pourra être à l'origine des destructions articulaires, associant des érosions osseuses et un pincement de l'interligne articulaire signant la chondrolyse et faisant la gravité de la maladie.
![]() Le ou les agents pathogènes à l'origine de la PR sont inconnus à ce jour. Le primum movens pourrait être une réaction inflammatoire survenant à distance de la cavité articulaire, générant des peptides citrullinés, via l'activation de peptidylarginine déiminases. Ces peptides citrullinés seraient apprêtés et présentés par les cellules dendritiques et les macrophages, exprimant des molécules HLA de classe II caractérisées par une séquence peptidique commune dénommée « épitope partagé », localisée au sein de la troisième région hypervariable des chaînes bêta des molécules HLA-DR4 ou HLA-DR1, aux lymphocytes T CD4+ naïfs, s'activant et se différenciant en lymphocytes T de type Th1 (notamment producteurs d'interféron γ et d'IL-2) ou Th17 (notamment producteurs d'IL-17), contribuant à la production de cytokines pro-inflammatoires et à l'activation et à la différenciation des lymphocytes B autoréactifs, synthétisant le FR et les ACPA.
Le ou les agents pathogènes à l'origine de la PR sont inconnus à ce jour. Le primum movens pourrait être une réaction inflammatoire survenant à distance de la cavité articulaire, générant des peptides citrullinés, via l'activation de peptidylarginine déiminases. Ces peptides citrullinés seraient apprêtés et présentés par les cellules dendritiques et les macrophages, exprimant des molécules HLA de classe II caractérisées par une séquence peptidique commune dénommée « épitope partagé », localisée au sein de la troisième région hypervariable des chaînes bêta des molécules HLA-DR4 ou HLA-DR1, aux lymphocytes T CD4+ naïfs, s'activant et se différenciant en lymphocytes T de type Th1 (notamment producteurs d'interféron γ et d'IL-2) ou Th17 (notamment producteurs d'IL-17), contribuant à la production de cytokines pro-inflammatoires et à l'activation et à la différenciation des lymphocytes B autoréactifs, synthétisant le FR et les ACPA.
Au sein de la synovite rhumatoïde, on observe une accumulation de cellules de l'immunité (macrophages, lymphocytes T et B), ainsi qu'une prolifération des cellules résidentes de la membrane synoviale, appelées synoviocytes. Les synoviocytes de type macrophagique contribuent notamment à la production de cytokines pro-inflammatoires, telles que le TNFα (Tumor Necrosis Factor α), l'IL-1 et l'IL-6, amplifiant la réaction inflammatoire et favorisant le recrutement intra-articulaire de monocytes, de lymphocytes et de polynucléaires neutrophiles issus du compartiment sanguin, sous l'action de cytokines à activité chimiotactique et de l'expression des molécules d'adhérence par les cellules endothéliales. Les synoviocytes de type fibroblastique contribuent quant à eux à la production de PGE2 et de métalloprotéinases matricielles, capables de dégrader le collagène de type II et les protéines non collagéniques de la matrice extracellulaire du cartilage articulaire, générant la chondrolyse.
Les cytokines pro-inflammatoires jouent un rôle clé dans la genèse de la synovite rhumatoïde, ou pannus synovial, ainsi que dans les destructions ostéoarticulaires caractéristiques de la maladie. La PR est caractérisée par un déséquilibre entre un excès de production de cytokines pro-inflammatoires, tels le TNFα, l'IL-1 et l'IL-6 et un déficit de production de cytokines anti-inflammatoires, tels l'IL-4, l'IL-10 et l'IL-13, les récepteurs solubles du TNF et l'antagoniste du récepteur de l'IL-1. Des cytokines favorisant l'angiogenèse et la prolifération cellulaire sont également présentes dans la membrane synoviale : TGFβ, VEGF, PDGF et FGF-1 et 2. Cette angiogenèse contribue au recrutement de monocytes, de lymphocytes et de polynucléaires neutrophiles issus du compartiment sanguin.
Au même titre que les synoviocytes, les préostéoclastes peuvent être considérés comme des cellules résidentes de l'articulation. Ils siègent dans l'os sous-chondral, au contact du pannus synovial, concentrés dans les zones d'insertion et de réflexion de la capsule articulaire. Les préostéoclastes sont activés et différenciés en ostéoclastes via la liaison de leur récepteur transmembranaire activateur de NF-κB (RANK) à son ligand (RANKL), notamment exprimé par les lymphocytes T de type Th17 et les synoviocytes fibroblastiques et sécrété sous forme soluble par les cellules de l'inflammation, sous l'action des cytokines pro-inflammatoires. Les ostéoclastes sont les cellules effectrices des érosions osseuses observées dans la PR.
Le rôle central des cellules de l'immunité (lymphocytes T et B) et des cytokines pro-inflammatoires dans la pathogénie de la PR a fait de ces cellules et de ces médiateurs intercellulaires des cibles thérapeutiques potentielles validées au cours de ces trente dernières années : biomédicaments ciblant spécifiquement les cytokines pro-inflammatoires (anti-TNF) ou leurs récepteurs (anti-IL-6R), les lymphocytes B (anti-CD20) ou les voies de costimulation des lymphocytes T (CTLA4-Ig) ou petites molécules ciblant spécifiquement les voies de signalisation intracellulaire des récepteurs des cytokines de la réponse immunitaire ou de la réaction inflammatoire (inhibiteurs des Janus kinases).
![]() Le diagnostic de PR débutante repose sur les données issues de l'examen clinique et d'examens biologiques et radiographiques, complétés par un examen échographique en cas de doute sur l'existence d'une ou plusieurs synovites.
Le diagnostic de PR débutante repose sur les données issues de l'examen clinique et d'examens biologiques et radiographiques, complétés par un examen échographique en cas de doute sur l'existence d'une ou plusieurs synovites.
Le diagnostic de PR doit être aussi précoce que possible ![]() , afin d'initier, dès la confirmation diagnostique par le rhumatologue, un traitement de fond visant à obtenir et à maintenir un état de rémission ou, à défaut, de faible niveau d'activité de la maladie, permettant de prévenir les signes radiographiques, le handicap fonctionnel et les complications systémiques de l'inflammation, tout en préservant la qualité de vie et les capacités socioprofessionnelles du patient.
, afin d'initier, dès la confirmation diagnostique par le rhumatologue, un traitement de fond visant à obtenir et à maintenir un état de rémission ou, à défaut, de faible niveau d'activité de la maladie, permettant de prévenir les signes radiographiques, le handicap fonctionnel et les complications systémiques de l'inflammation, tout en préservant la qualité de vie et les capacités socioprofessionnelles du patient.
Dans 70 à 80 % des cas, le tableau est celui d'une polyarthrite acromélique, bilatérale et globalement symétrique, sans manifestations extra-articulaires ou systémiques (polyarthrite « nue »), évoluant sur un mode chronique (> 6 semaines), caractérisée par :
Fig. 17-1 :![]() Gonflements des articulations métacarpophalangiennes et des articulations interphalangiennes proximales de l'index et du majeur (aspect en fuseau) dans le cadre d'une polyarthrite débutante.
Gonflements des articulations métacarpophalangiennes et des articulations interphalangiennes proximales de l'index et du majeur (aspect en fuseau) dans le cadre d'une polyarthrite débutante.
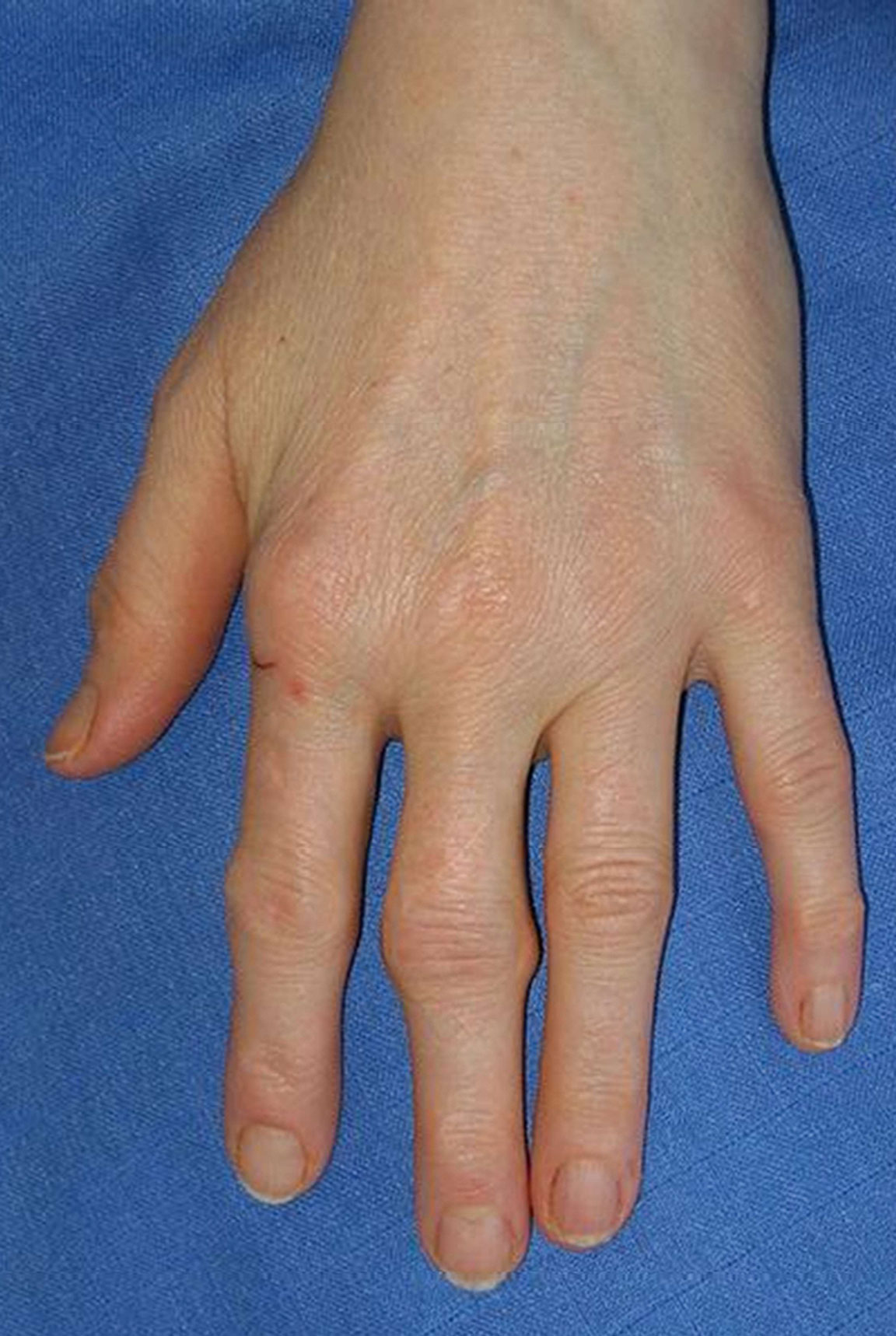
Tableau 17.1 : ![]() Principaux éléments du diagnostic positif et du diagnostic différentiel d'une polyarthrite rhumatoïde débutante.
Principaux éléments du diagnostic positif et du diagnostic différentiel d'une polyarthrite rhumatoïde débutante.
| Diagnostic positif d'une polyarthrite rhumatoïde débutante | |
|---|---|
| Signes cliniques | |
Signes biologiques
Signes d'imagerie
Diagnostic différentiel d'une polyarthrite rhumatoïde débutanteSignes cliniquesAbsence de manifestations extra-rhumatologiques pouvant orienter vers d'autres affections s'accompagnant d'arthrites périphériquesSignes biologiquesAbsence d'anomalies de l'hémogramme, de la bandelette urinaire, du dosage des transaminases ou de la recherche d'anticorps antinucléaires pouvant orienter vers d'autres affections s'accompagnant d'arthrites périphériquesSignes d'imagerieAbsence d'anomalies des radiographies standards des articulations ou de la radiographie thoracique pouvant orienter vers d'autres affections s'accompagnant d'arthrites périphériques
Les articulations interphalangiennes distales sont habituellement respectées au cours de la PR, contrairement à ce qui est observé au cours du rhumatisme psoriasique, de la goutte ou de l'arthrose.
D'autres formes cliniques sont possibles dans 20 à 30 % des cas :
Les radiographies standards à demander systématiquement dans le cadre d'une PR débutante sont :
Elles sont le plus souvent normales dans la PR débutante et servent d'examen de référence ![]() .
.
Elles peuvent montrer de façon précoce des lésions structurales à type d'érosions osseuses ou des pincements des interlignes articulaires, notamment sur les carpes, les articulations métacarpophalangiennes et les articulations interphalangiennes proximales des doigts et les articulations métatarsophalangiennes, en particulier en regard des têtes des cinquièmes métatarsiens (fig. 17.2).
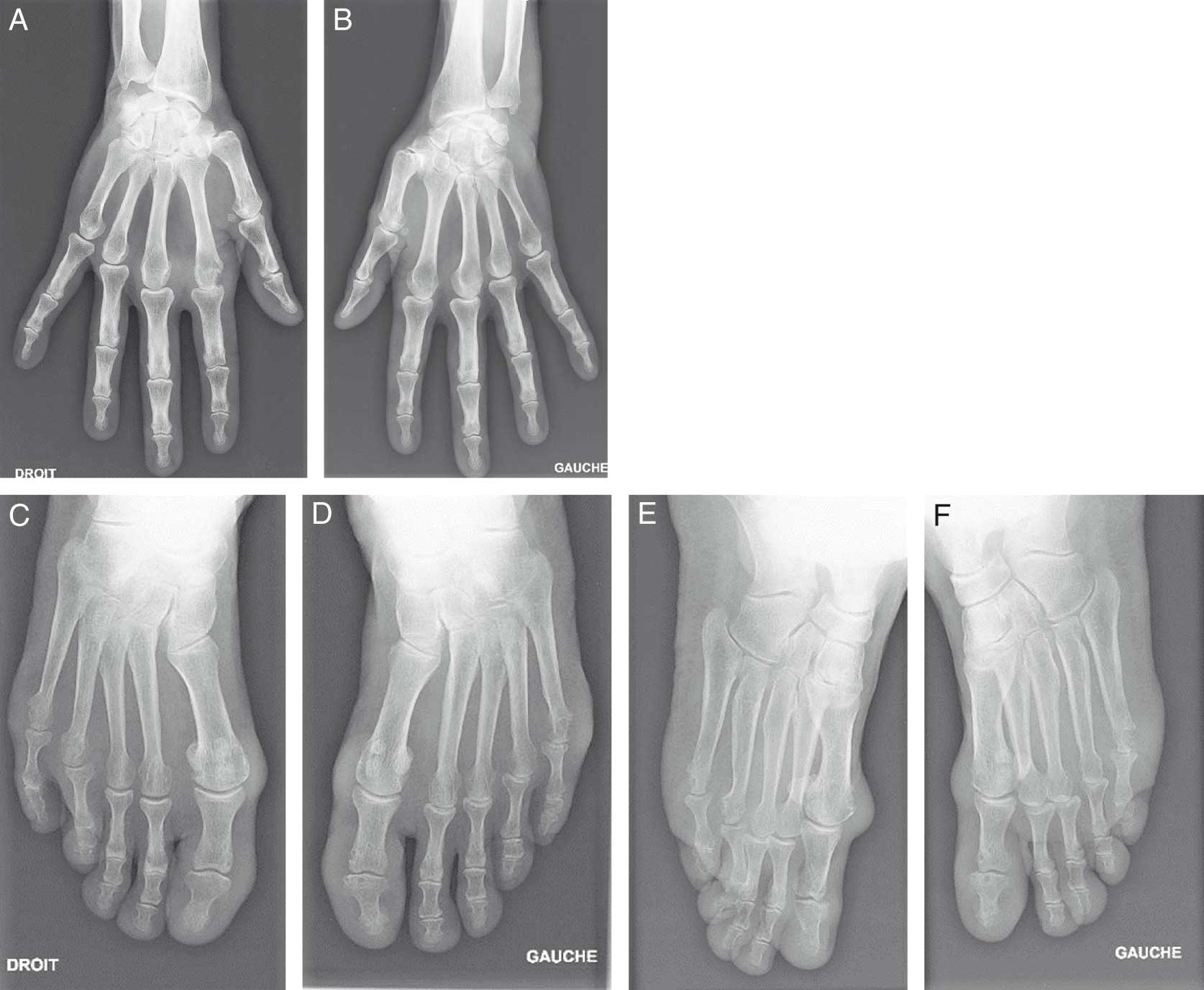
Fig. 17-2 :![]() Polyarthrite rhumatoïde : érosions osseuses et pincements.
Polyarthrite rhumatoïde : érosions osseuses et pincements.
Radiographie des mains de face : érosion de la MCP2 droite (A) et pincement des MCP2 et MCP3 bilatéral (A et B). Radiographie des pieds de face (C, D) et trois quarts (E, F) : érosion des 5es têtes métacarpiennes et de la 4e droite.
Un radiographie thoracique sera également réalisée (éliminer un diagnostic différentiel et avant de débuter le méthotrexate).![]() Dans le cadre d'une PR débutante, il est utile de répéter les radiographies des mains, des pieds et des autres articulations inflammatoires tous les 6 mois au cours de la première année puis tous ans au cours des 3 premières années. La périodicité des contrôles est ensuite adaptée en tenant compte de l'existence ou de la progression des lésions structurales et de l'atteinte de l'objectif thérapeutique de rémission ou, à défaut, de faible niveau d'activité de la maladie qui se traduit, chez la grande majorité des patients atteignant ces objectifs, par l'absence de progression des lésions structurales.
Dans le cadre d'une PR débutante, il est utile de répéter les radiographies des mains, des pieds et des autres articulations inflammatoires tous les 6 mois au cours de la première année puis tous ans au cours des 3 premières années. La périodicité des contrôles est ensuite adaptée en tenant compte de l'existence ou de la progression des lésions structurales et de l'atteinte de l'objectif thérapeutique de rémission ou, à défaut, de faible niveau d'activité de la maladie qui se traduit, chez la grande majorité des patients atteignant ces objectifs, par l'absence de progression des lésions structurales.![]() Une échographie articulaire (fig. 17.3) est à réaliser en cas de doute sur la présence d'une synovite ou d'une ténosynovite ou pour évaluer l'activité de la maladie. Elle permet de visualiser :
Une échographie articulaire (fig. 17.3) est à réaliser en cas de doute sur la présence d'une synovite ou d'une ténosynovite ou pour évaluer l'activité de la maladie. Elle permet de visualiser :
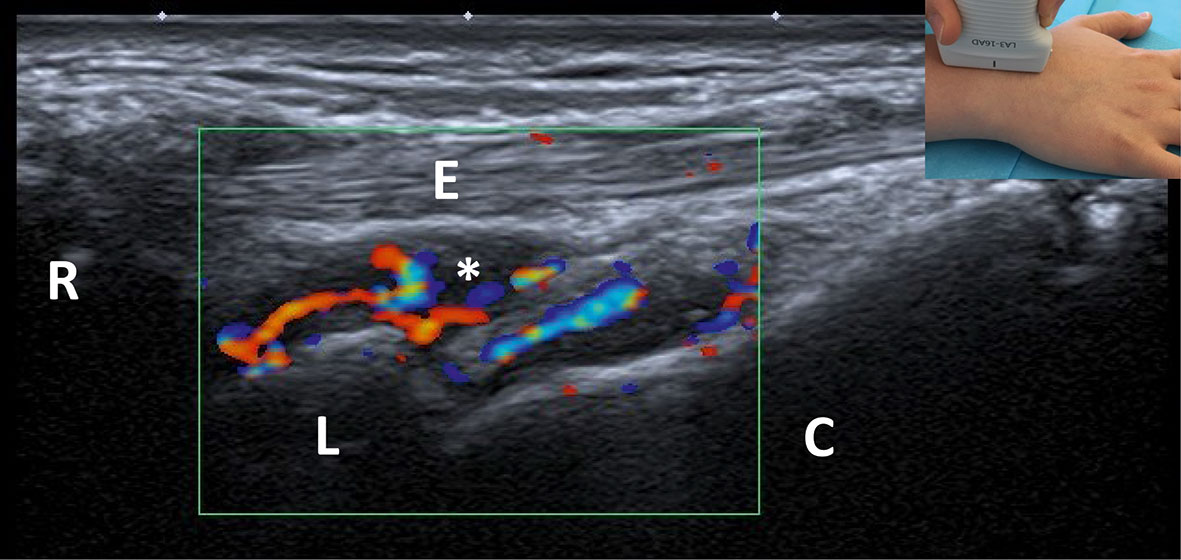
Fig. 17-3 :![]() Échographie-doppler de la face dorsale du poignet.
Échographie-doppler de la face dorsale du poignet.
On voit sur cette image une synovite hypoéchogène (*), avec positivité du doppler traduisant l'existence d'une hypervascularisation de la membrane synoviale.
R : radius ; L : lunatum ; C : capitatum ; E : tendons du muscle extenseur des doigts.
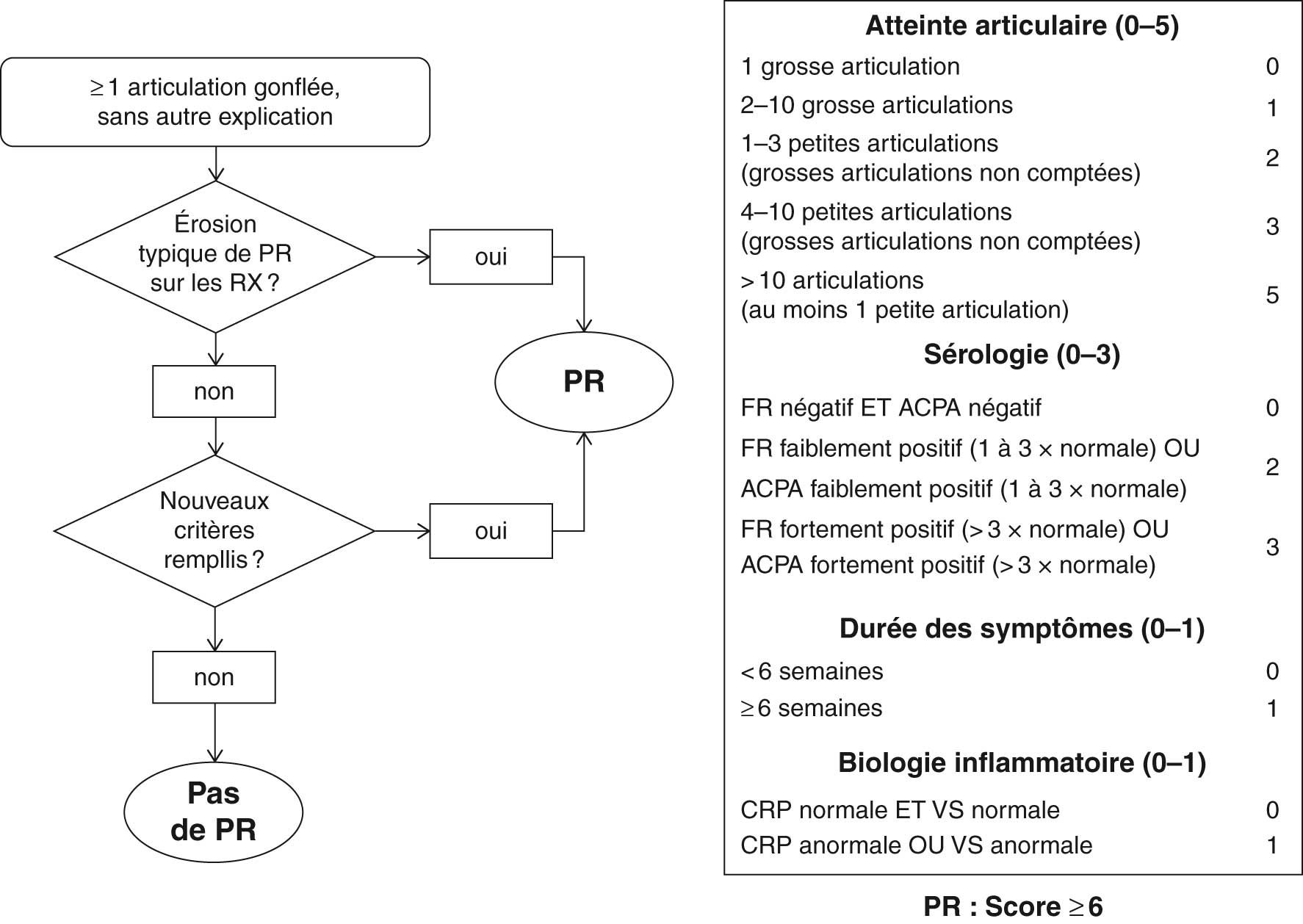
![]() Des critères de classification de la PR (fig. 17.4) ont été établis en 2010 de façon collégiale par des rhumatologues européens et américains à partir de cohortes de patients et de cas patients atteints d'arthrites débutantes. Ils peuvent aider le clinicien pour le diagnostic de PR débutante.
Des critères de classification de la PR (fig. 17.4) ont été établis en 2010 de façon collégiale par des rhumatologues européens et américains à partir de cohortes de patients et de cas patients atteints d'arthrites débutantes. Ils peuvent aider le clinicien pour le diagnostic de PR débutante.
Fig. 17-4 :
![]() Critères de classification 2010 de la polyarthrite rhumatoïde (PR) selon les Collèges européen et américain de rhumatologie.
Critères de classification 2010 de la polyarthrite rhumatoïde (PR) selon les Collèges européen et américain de rhumatologie.
(Source : Gaujoux-Viala C, Gossec L, Cantagrel A, et al. Recommandations de la Société française de rhumatologie pour la prise en charge de la polyarthrite rhumatoïde. Rev Rhum 2014 ;81:303–12.)
![]() Le recueil systématique de ces paramètres, lors de la visite initiale puis lors des visites de suivi, permet une quantification initiale et un suivi standardisé de l'évolution de l'activité de la maladie, reposant sur un score validé d'activité de la maladie dénommé DAS28 (Disease Activity Score). Les articulations incluses dans ce score sont : 2 épaules, 2 coudes, 2 poignets, 10 métacarpophalangiennes, 10 interphalangiennes proximales des doigts et 2 genoux.
Le recueil systématique de ces paramètres, lors de la visite initiale puis lors des visites de suivi, permet une quantification initiale et un suivi standardisé de l'évolution de l'activité de la maladie, reposant sur un score validé d'activité de la maladie dénommé DAS28 (Disease Activity Score). Les articulations incluses dans ce score sont : 2 épaules, 2 coudes, 2 poignets, 10 métacarpophalangiennes, 10 interphalangiennes proximales des doigts et 2 genoux.
Encadré 17.1 (D'après : Daien C, Hua C, Gaujoux-Viala C, et al. Actualisation des Recommandations de la Société française de rhumatologie pour la prise en charge de la polyarthrite rhumatoïde. Rev Rhum 2019;86:8–24.)
Paramètres d'évaluation de l'activité et niveaux d'activité d'une polyarthrite rhumatoïde selon le DAS28-VS
Niveaux d'activité de la PR définis à partir du résultat du calcul du DAS28
Au sein du faisceau d'arguments cliniques, biologiques et d'imagerie permettant au rhumatologue d'établir le diagnostic de PR, la présence et la précocité d'un ou plusieurs des éléments suivants constituent des facteurs pronostiques de sévérité structurale, fonctionnelle et/ou globale.
Encadré 17.2 Facteurs pronostiques de sévérité structurale, fonctionnelle et/ou globale d'une polyarthrite rhumatoïde
HAQ : Health Assessment Questionnaire, questionnaire d'incapacité fonctionnelle spécifique de la PR, portant sur huit domaines d'activité de la vie quotidienne, coté de 0 à 3, un score de 0 correspondant à l'absence d'incapacité et un score de 3 correspondant à une incapacité maximale.
Les critères de classification de la PR soulignent la nécessité de s'assurer que les gonflements articulaires ne sont pas expliqués par une autre maladie ![]() .
.
L'interrogatoire et l'examen physique sont essentiels pour rechercher des manifestations extra-rhumatologiques pouvant orienter vers ces diverses affections, pouvant être révélées par des arthrites périphériques.
Il convient notamment d'écarter les arthropathies infectieuses, les arthrites microcristallines, le rhumatisme psoriasique et les autres formes périphériques de spondyloarthrites, les connectivites dont la maladie de Gougerot-Sjögren, le lupus systémique et la sclérodermie systémique, ainsi que certaines vascularites, granulomatoses et maladies auto-inflammatoires à expression articulaire.
Un certain nombre d'examens complémentaires sont utiles dans le cadre du diagnostic différentiel :
![]() La précocité du diagnostic et de l'initiation d'un traitement de fond synthétique conventionnel (csDMARD) puis, si nécessaire, d'un traitement de fond biologique (bDMARD), visant à obtenir et à maintenir un état de rémission ou, à défaut, de faible niveau d'activité de la maladie, ont non seulement pour objectifs de prévenir les manifestations ostéoarticulaires de la phase d'état, mais aussi de diminuer l'incidence et la sévérité des manifestations extra-articulaires ou systémiques et de préserver l'espérance de vie des patients, habituellement menacée par les comorbidités cardiovasculaires, infectieuses ou tumorales.
La précocité du diagnostic et de l'initiation d'un traitement de fond synthétique conventionnel (csDMARD) puis, si nécessaire, d'un traitement de fond biologique (bDMARD), visant à obtenir et à maintenir un état de rémission ou, à défaut, de faible niveau d'activité de la maladie, ont non seulement pour objectifs de prévenir les manifestations ostéoarticulaires de la phase d'état, mais aussi de diminuer l'incidence et la sévérité des manifestations extra-articulaires ou systémiques et de préserver l'espérance de vie des patients, habituellement menacée par les comorbidités cardiovasculaires, infectieuses ou tumorales.
Actuellement, les tableaux décrits ci-dessous ne devraient donc plus se voir chez un patient débutant une PR.
Les gonflements articulaires, initialement réversibles, traduisant la présence d'une synovite et/ou d'un épanchement liquidien intra-articulaire, peuvent évoluer, en l'absence de prise en charge thérapeutique efficace, vers des déformations ostéoarticulaires irréversibles, traduisant les lésions des structures capsuloligamentaires et ostéocartilagineuses. Ces déformations sont plus rares à l'heure actuelle grâce aux avancées thérapeutiques de ces dernières années.
L'ensemble des articulations périphériques peuvent être touchées, ainsi que le rachis cervical au niveau C1-C2, la PR respectant le rachis thoracolombaire et les sacro-iliaques.
L'atteinte des mains est la plus fréquente et la plus précoce.
Parmi les déformations caractéristiques des doigts, on citera notamment :
Fig. 17-5 :![]() Polyarthrite rhumatoïde établie avec atteinte des doigts : déformations élémentaires ; « coup de vent » ulnaire des doigts (secondaire à une déviation radiale du poignet et à un subluxation-dislocation des MCP).
Polyarthrite rhumatoïde établie avec atteinte des doigts : déformations élémentaires ; « coup de vent » ulnaire des doigts (secondaire à une déviation radiale du poignet et à un subluxation-dislocation des MCP).
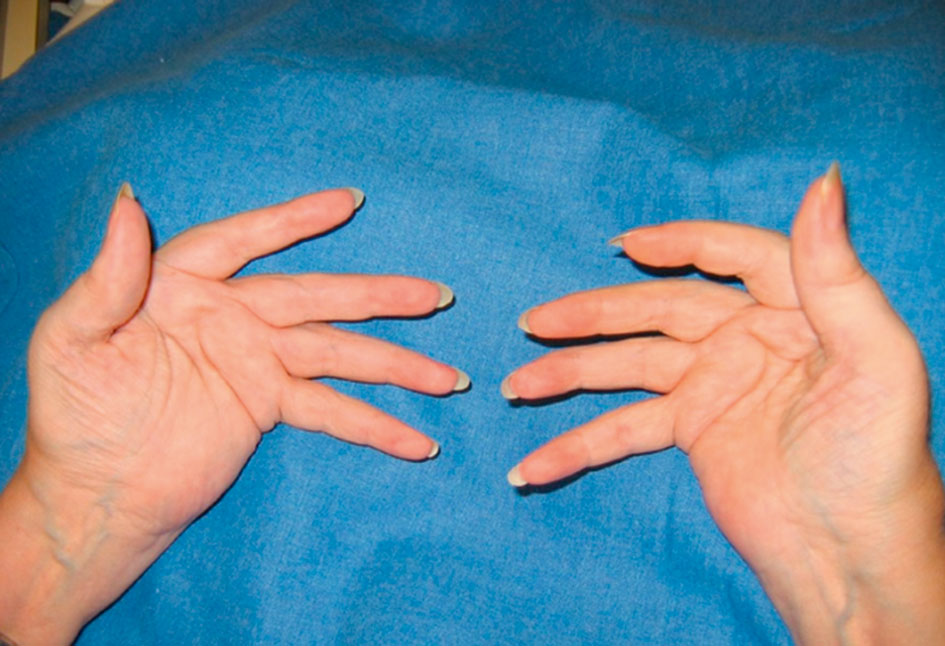
Fig. 17-6 :![]() Déformation en « col de cygne ».
Déformation en « col de cygne ».
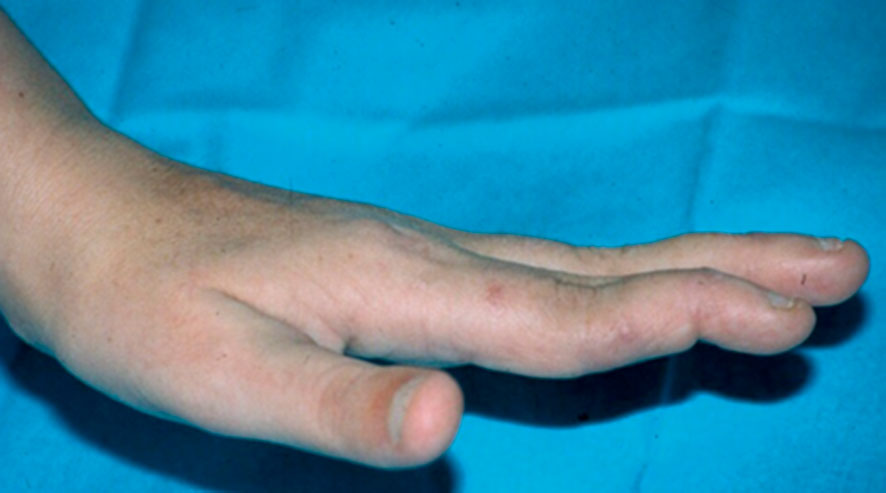
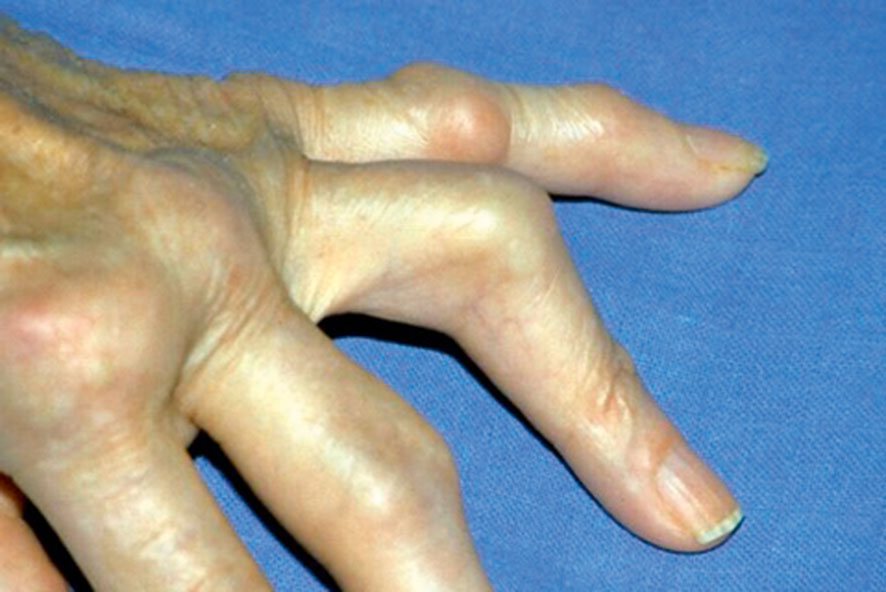
Fig. 17-7 :![]() Déformation en « boutonnière ».
Déformation en « boutonnière ».
![]() Parmi les déformations caractéristiques des poignets, on citera notamment :
Parmi les déformations caractéristiques des poignets, on citera notamment :
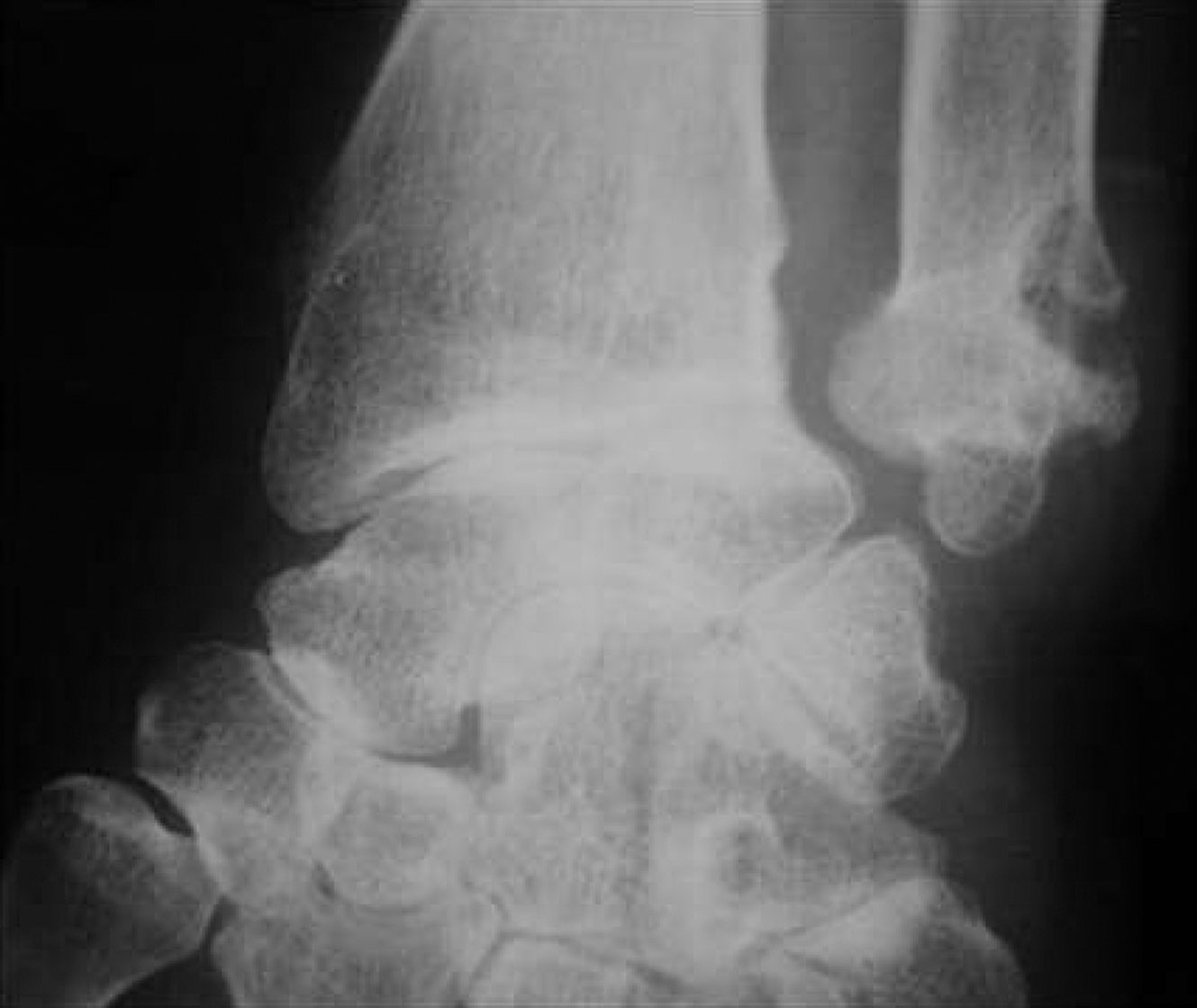
Fig. 17-8 :![]() Érosions de la styloïde ulnaire, arthrite radio-ulnaire distale, pincement radiocarpien et pincement des interlignes articulaires du carpe (carpite) dans le cadre d'une PR à la phase d'état.
Érosions de la styloïde ulnaire, arthrite radio-ulnaire distale, pincement radiocarpien et pincement des interlignes articulaires du carpe (carpite) dans le cadre d'une PR à la phase d'état.
L'ensemble de ces lésions contribuent à la déviation ulnaire en « coup de vent » des doigts.
Parmi les déformations caractéristiques de l'avant-pied, on citera notamment :
Ces déformations ostéoarticulaires et ces lésions cutanées se compliquent fréquemment d'ulcérations cutanées, constituant des portes d'entrée infectieuses potentielles (fig. 17.9).
Fig. 17-9 :![]() Avant-pied triangulaire combinant un hallux valgus, un « coup de vent » fibulaire des orteils et un quintus varus, avec une hyperextension de la première phalange, des signes d'hyperkératose et une ulcération de la face dorsale de l'articulation interphalangienne du deuxième orteil dans le cadre d'une polyarthrite rhumatoïde à la phase d'état.
Avant-pied triangulaire combinant un hallux valgus, un « coup de vent » fibulaire des orteils et un quintus varus, avec une hyperextension de la première phalange, des signes d'hyperkératose et une ulcération de la face dorsale de l'articulation interphalangienne du deuxième orteil dans le cadre d'une polyarthrite rhumatoïde à la phase d'état.
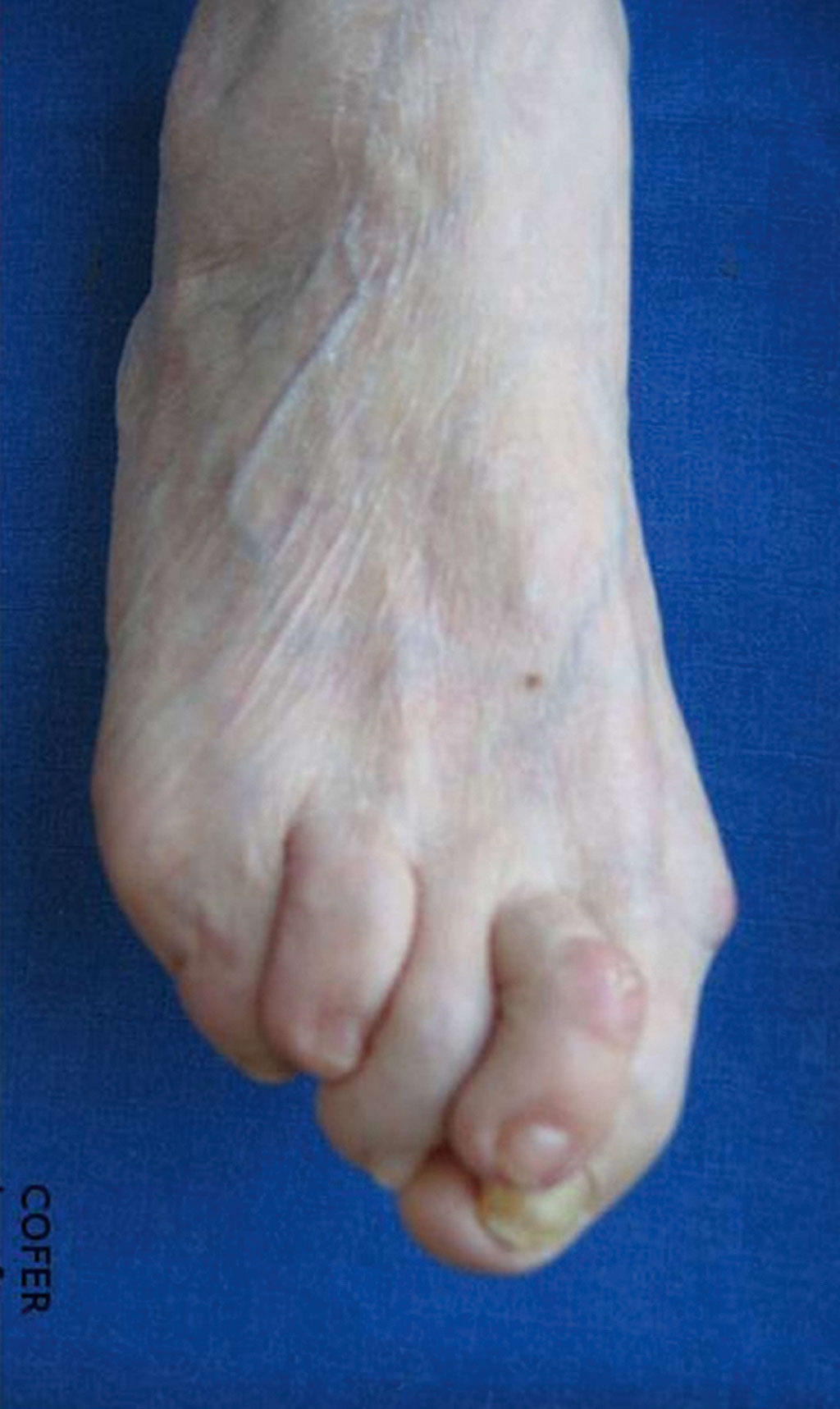
L'atteinte du médio-pied et de l'arrière-pied se manifeste le plus souvent par un aspect de pied plat valgus, initialement réductible, puis fixé, combinant un effondrement de l'arche longitudinale médiale et un valgus calcanéen, traduisant fréquemment la combinaison d'une arthrite talonaviculaire, d'une arthrite sous-talienne et d'une arthrite calcanéocuboïdienne. Cette atteinte est fréquemment associée à des lésions tendineuses et à une ténosynovite du tendon tibial postérieur.
L'atteinte des épaules est assez fréquente, souvent méconnue, combinant une arthrite scapulo-humérale et une bursite sous-acromio-deltoïdienne, à l'origine de pincement de l'interligne scapulo-huméral, de volumineuses érosions de l'extrémité supérieure de l'humérus et de lésions des tendons de la coiffe des rotateurs.
L'atteinte des coudes se traduit par des lésions ostéoarticulaires à l'origine d'un déficit d'extension et d'une majoration du valgus physiologique, avec un flessum initialement réversible, puis rapidement fixé.
Les genoux sont le siège d'arthrites pouvant concerner les trois compartiments articulaires, notamment le compartiment latéral, se traduisant par un genu valgum et un flessum du genou dans les formes évoluées. L'épanchement liquidien intra-articulaire s'accompagne fréquemment d'un kyste du creux poplité.
La coxite rhumatoïde est plus rare, exceptionnellement inaugurale, souvent méconnue, conduisant à une limitation majeure de la mobilité de la coxofémorale, associée à une attitude vicieuse en flessum.
L'atteinte du rachis cervical semble plus fréquente chez les PR masculines, séropositives, érosives et nodulaires. Elle concerne en premier lieu la charnière cervico-occipitale et le rachis cervical haut, associant arthrite occipito-atloïdienne, arthrite atloïdo-axoïdienne et pannus synovial avec érosions de l'odontoïde et rupture du ligament transverse de l'atlas, à l'origine de subluxations atloïdo-axoïdiennes antérieures et plus rarement verticales. Elle associe une limitation douloureuse de la mobilité cervicale, notamment dans les mouvements de rotation, à des manifestations neurologiques sensitives et motrices des membres supérieurs et inférieurs, traduisant une compression médullaire cervicale haute. Les clichés standards du rachis cervical de face et de profil, le cliché C1-C2 bouche ouverte et les clichés dynamiques de profil en flexion et en extension, déconseillés en cas de signes neurologiques, permettent une première évaluation des lésions structurales et de l'importance du diastasis atloïdo-axoïdien. Ce sont surtout le scanner, pour l'analyse des lésions osseuses et de leur retentissement canalaire, et l'IRM, pour la quantification du pannus synovial et l'évaluation du retentissement médullaire, qui permettent de préciser au mieux le risque neurologique et de guider le neurochirurgien en vue d'un geste de stabilisation de la charnière cervico-occipitale et du rachis cervical haut.
![]() Les manifestations extra-articulaires de la PR traduisent le caractère systémique de la maladie. Elles sont inconstantes, constituant un facteur pronostique de sévérité de la maladie et pouvant parfois menacer le pronostic vital.
Les manifestations extra-articulaires de la PR traduisent le caractère systémique de la maladie. Elles sont inconstantes, constituant un facteur pronostique de sévérité de la maladie et pouvant parfois menacer le pronostic vital.
Un syndrome de Gougerot-Sjögren secondaire est retrouvé chez 10 à 30 % des patients atteints de PR, souvent révélé par des signes de xérophtalmie.
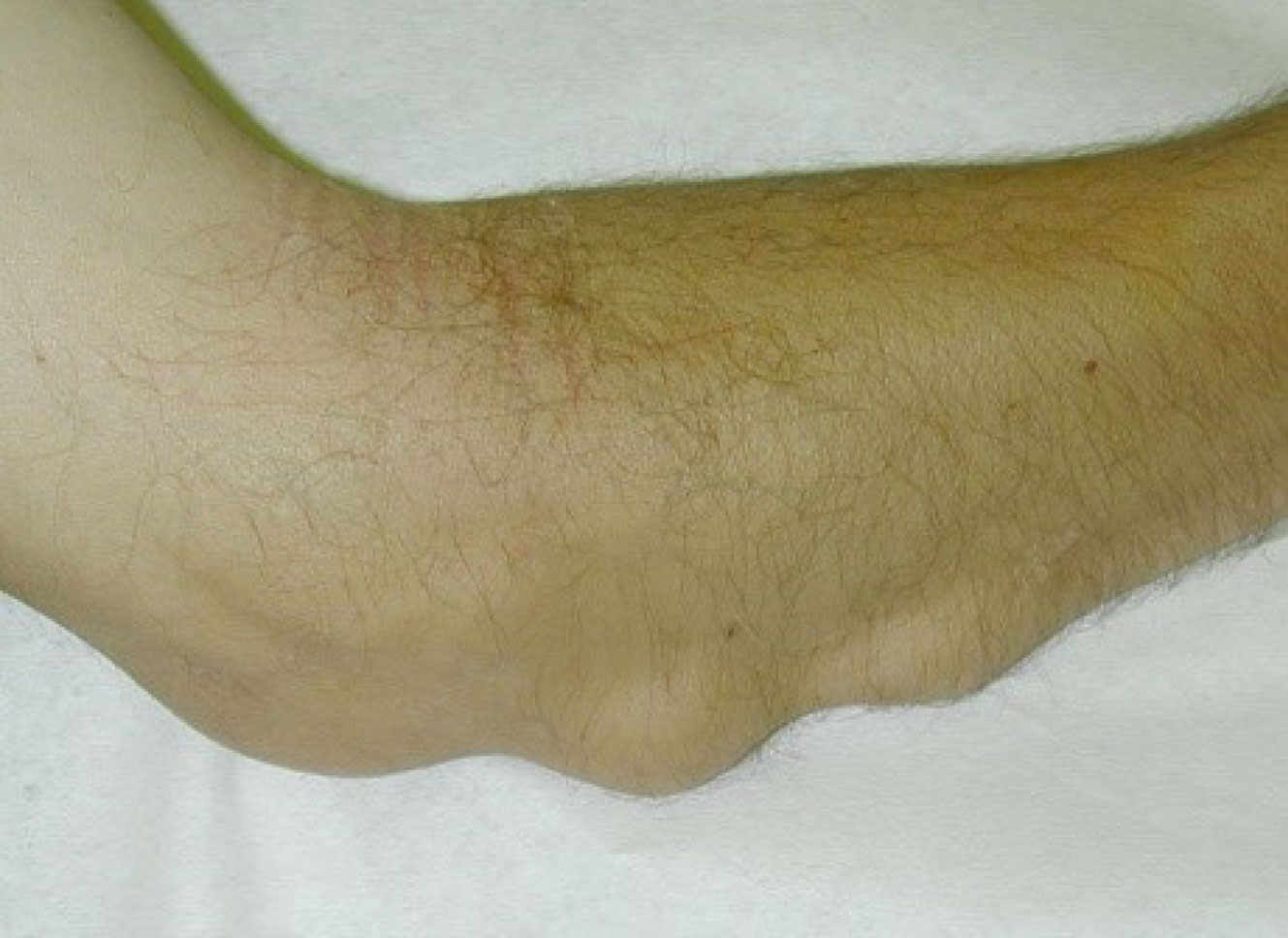
Fig. 17-10 :![]() Nodules rhumatoïdes en regard de la crête ulnaire illustrant une des manifestations extra-articulaires de la PR à la phase d'état.
Nodules rhumatoïdes en regard de la crête ulnaire illustrant une des manifestations extra-articulaires de la PR à la phase d'état.
![]() L'incidence des manifestations pleuropulmonaires de la PR est sous-estimée car elles sont souvent asymptomatiques, mal visualisées par le cliché thoracique systématiquement réalisé au début de la maladie, révélant des anomalies dans moins de 10 % des cas, bien visualisées par la réalisation d'un scanner thoracique haute résolution chez les patients symptomatiques (toux, dyspnée, anomalies auscultatoires) montrant des anomalies dans 20 à 50 % des cas.
L'incidence des manifestations pleuropulmonaires de la PR est sous-estimée car elles sont souvent asymptomatiques, mal visualisées par le cliché thoracique systématiquement réalisé au début de la maladie, révélant des anomalies dans moins de 10 % des cas, bien visualisées par la réalisation d'un scanner thoracique haute résolution chez les patients symptomatiques (toux, dyspnée, anomalies auscultatoires) montrant des anomalies dans 20 à 50 % des cas.
Ces manifestations pleuropulmonaires comportent :
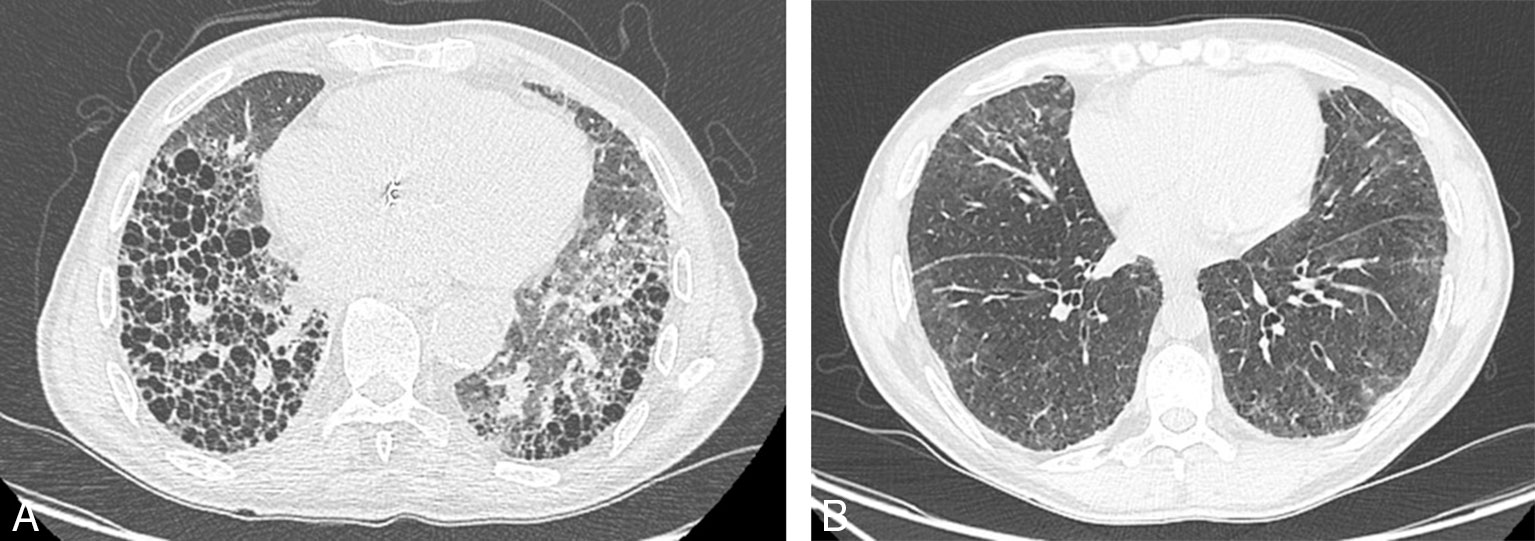
Les pneumopathies interstitielles diffuses constituent la manifestation pleuropulmonaire la plus fréquente, notamment chez les hommes, tabagiques, avec une PR nodulaire et une forte positivité du FR et surtout des ACPA. Les pneumopathies interstitielles non spécifiques et les pneumopathies interstitielles communes en sont les deux principaux types (fig. 17.11). Elles restent longtemps asymptomatiques. Elles sont potentiellement sévères, associées à la surmortalité, à la diminution de l'espérance de vie de la PR.
Fig. 17-11 :![]() Pneumopathie interstitielle diffuse illustrant une des manifestations extra-articulaires graves de la polyarthrite rhumatoïde à la phase d'état.
Pneumopathie interstitielle diffuse illustrant une des manifestations extra-articulaires graves de la polyarthrite rhumatoïde à la phase d'état.
A. Pneumonie interstitielle commune. B. Pneumonie interstitielle non spécifique.
![]() On citera pour mémoire le syndrome de Caplan-Colinet, caractérisé par l'association d'une PR et d'une pneumoconiose, en relation avec l'exposition à la poussière de silice.
On citera pour mémoire le syndrome de Caplan-Colinet, caractérisé par l'association d'une PR et d'une pneumoconiose, en relation avec l'exposition à la poussière de silice.
L'atteinte cardiaque de la PR est essentiellement représentée par des péricardites, souvent asymptomatiques, découvertes à l'occasion de la réalisation d'une échocardiographie ou d'un scanner thoracique, parfois symptomatiques, devant conduire à enquête étiologique complète (infection virale, bactérienne ou mycobactérienne, autre connectivite, infarctus du myocarde, néoplasie…) avant de conclure à la responsabilité de la PR. Des myocardites, des troubles du rythme ou de la conduction ou des endocardites ont été rapportés au cours de la PR, dont la responsabilité ne peut là encore être retenue qu'après une enquête étiologique exhaustive.
La PR est surtout associée à une augmentation de la morbi-mortalité cardiovasculaire, avec un surrisque de maladie coronarienne ou d'accident vasculaire cérébral de l'ordre de 50 % comparativement à la population générale, comparable à celui observé au cours du diabète de type 2. Cette augmentation de la morbi-mortalité cardiovasculaire traduit d'une part la surreprésentation de certains facteurs de risque cardiovasculaire traditionnels (tabagisme et diabète de type 2 notamment), d'autre part les conséquences cardiovasculaires de l'inflammation chronique se traduisant par une athérosclérose accélérée, enfin l'impact cardiovasculaire péjoratif de la corticothérapie générale. Elle impose d'évaluer et de contrôler au mieux les facteurs de risque cardiovasculaire traditionnels, en considérant la PR comme un facteur de risque cardiovasculaire indépendant, dont l'impact cardiovasculaire peut être réduit en atteignant l'objectif de rémission ou de faible niveau d'activité de la maladie, avec un csDMARD (méthotrexate) en monothérapie ou combiné à un bDMARD (anti-TNF).
La scléromalacie perforante concerne moins de 1 % des patients ; elle constitue l'atteinte oculaire la plus sévère, devant la sclérite et l'épisclérite concernant moins de 5 % des patients. Ces manifestations oculaires surviennent habituellement dans le cadre de PR féminines, avec positivité du FR. Elles sont souvent peu douloureuses, pouvant se compliquer de perforation sclérale. Leur mécanisme ferait intervenir des lésions de vascularite à complexes immuns.
Des adénopathies superficielles, mobiles, de petite taille, sont retrouvées chez 20 à 30 % des patients.
Le syndrome de Felty associe une PR, souvent ancienne et nodulaire, avec positivité du FR, une splénomégalie et une neutropénie. Il peut comporter des ulcères cutanés, une hyperpigmentation cutanée, une polynévrite, une épisclérite, une anémie, une positivité des anticorps antinucléaires. Il expose à un risque d'infections bactériennes, proportionnel à la profondeur de la neutropénie.
Une leucémie à grands lymphocytes granuleux (LGL) peut survenir dans le cadre de la PR. Elle constitue un diagnostic différentiel du syndrome de Felty, puisqu'elle est aussi caractérisée par une splénomégalie et une neutropénie, souvent associée à une anémie et/ou une thrombopénie, avec une hyperlymphocytose inconstante. L'immunophénotypage des lymphocytes circulants avec étude du réarrangement des gènes du TCR confirme le caractère monoclonal de la prolifération lymphocytaire T (CD3+ CD4–CD8+ TCR+ CD16+ CD57+) ou plus rarement NK (CD3–CD4–CD8–TCR–CD16+ CD56+). L'évolution est habituellement favorable sous traitement de fond par méthotrexate.
La vascularite rhumatoïde est rare, concernant moins de 1 % des patients. Son incidence semble en déclin au cours de ces vingt dernières années. Elle survient habituellement dans le cadre de PR anciennes, masculines, tabagiques, avec positivité du FR et des ACPA. Elle associe des signes cutanés (purpura vasculaire, livedo réticulaire, ulcère cutané, infarctus péri-unguéal, nécrose distale des doigts ou des orteils), des signes neurologiques périphériques (mononévrite multiple ou polynévrite), des signes oculaires (épisclérite, sclérite, ulcération cornéenne) et plus rarement des signes cardiaques (péricardite, myocardite, syndrome coronarien), des signes pulmonaires (hémorragie alvéolaire), des signes digestifs (ischémie mésentérique), des signes rénaux (glomérulonéphrite) ou des signes neurologiques centraux.
Histologiquement, il s'agit d'une vascularite de vaisseaux de petit et de moyen calibre, avec un infiltrat de la paroi vasculaire constitué de cellules mononucléées ou de polynucléaires neutrophiles, de possibles lésions d'angéite nécrosante, sans micro-anévrisme.
Sur le versant cardiovasculaire, la PR est associée à une augmentation de la morbi-mortalité cardiovasculaire, qui impose un dépistage et une prise en charge des facteurs de risque cardiovasculaire traditionnels et un contrôle optimal de l'activité inflammatoire de la maladie.
Sur le versant tumoral, la PR est associée à un surrisque de lymphomes, qui seraient deux fois plus fréquents que dans la population générale. Le risque de lymphome concerne particulièrement les PR les plus actives et les plus sévères. Il s'agit principalement de lymphomes malins non hodgkiniens, de localisation ganglionnaire ou extraganglionnaire, développés à partir de cellules B matures (lymphomes diffus à grandes cellules B). Le risque de cancers bronchopulmonaires semble plus élevé dans la PR que dans la population générale, vraisemblablement en raison d'une plus grande prévalence du tabagisme. Le risque de cancers colorectaux semble moins élevé dans la PR que dans la population générale, peut-être grâce à l'effet protecteur des AINS. Le risque de cancers du sein semble légèrement moins élevé dans la PR que dans la population générale, peut-être grâce à un dépistage accru. Le risque de dysplasies et de cancers du col utérin pourrait être majoré chez les patientes traitées par anti-TNF, imposant une surveillance accrue.
Sur le versant infectieux, la PR est associée à une augmentation du risque d'infections, en relation avec la maladie mais aussi avec l'utilisation des csDMARD, des glucocorticoïdes et des bDMARD. La plupart des infections sont des infections bénignes, concernant principalement les voies aériennes supérieures, les voies urinaires et le revêtement cutané. Le risque d'infections sévères est majoré chez les patients traités par bDMARD comparativement à ceux recevant uniquement des csDMARD. En dehors des infections bactériennes et virales communautaires, certains bDMARD augmentent le risque d'infections opportunistes ou d'infections mycobactériennes, avec notamment une nette majoration de l'incidence des cas de tuberculose observée lors de la mise sur le marché anti-TNF, alors que les JAKi augmentent le risque de réactivation du VZV se traduisant par des zonas. Ce surrisque infectieux impose une évaluation individuelle du risque infectieux avant toute décision thérapeutique, une mise à jour systématique des vaccinations conformément au calendrier vaccinal, ainsi que des mesures de prévention spécifiques telles qu'une antibioprophylaxie antituberculeuse chez les patients à risque de tuberculose avant l'initiation d'un biomédicament.
La diminution de l'espérance de vie des patients atteints de PR serait en moyenne de 5 à 10 ans par rapport à la population générale, notamment en raison de la surmortalité cardiovasculaire, particulièrement chez les patients ayant les formes les plus actives et les plus sévères de la maladie. Les stratégies thérapeutiques actuelles, visant la rémission, faisant appel à des combinaisons de csDMARD (notamment le méthotrexate) et de bDMARD (notamment les anti-TNF) pourraient permettre une diminution de la surmortalité, notamment cardiovasculaire, chez les patients répondeurs comme cela a été suggéré dans certains registres de patients atteints de PR.
![]() Le rhumatologue coordonne la prise en charge thérapeutique des patients atteints de PR et en assure le suivi conjointement avec le médecin généraliste, qui joue un rôle central dans la coordination du parcours personnalisé de soins et dans la prise en charge des comorbidités.
Le rhumatologue coordonne la prise en charge thérapeutique des patients atteints de PR et en assure le suivi conjointement avec le médecin généraliste, qui joue un rôle central dans la coordination du parcours personnalisé de soins et dans la prise en charge des comorbidités.
L'annonce du diagnostic de PR au patient nécessite du temps médical. Le rhumatologue doit prendre le temps nécessaire pour délivrer l'information au patient à un rythme et sous une forme adaptée à sa capacité à recevoir et à assimiler cette information.
L'information sur la prise en charge thérapeutique doit être aussi complète que possible et insister sur le rapport bénéfice/risque du traitement médicamenteux et sur l'importance de l'observance du traitement prescrit.
Elle comporte notamment :
L'adhésion thérapeutique du patient est recherchée après lui avoir expliqué le rapport bénéfice/risque du traitement de fond et/ou de la corticothérapie et/ou du traitement symptomatique.
Les autres acteurs médicaux, paramédicaux, sociaux peuvent être présentés si le contexte clinique et socioprofessionnel le justifie.
Il est recommandé d'informer le médecin généraliste, les autres médecins spécialistes et les autres professionnels de santé concernés, afin d'organiser le suivi conjoint du patient. L'information doit porter sur le diagnostic et les modalités de prise en charge médicale et globale du patient.
Les objectifs de la prise en charge thérapeutique sont :
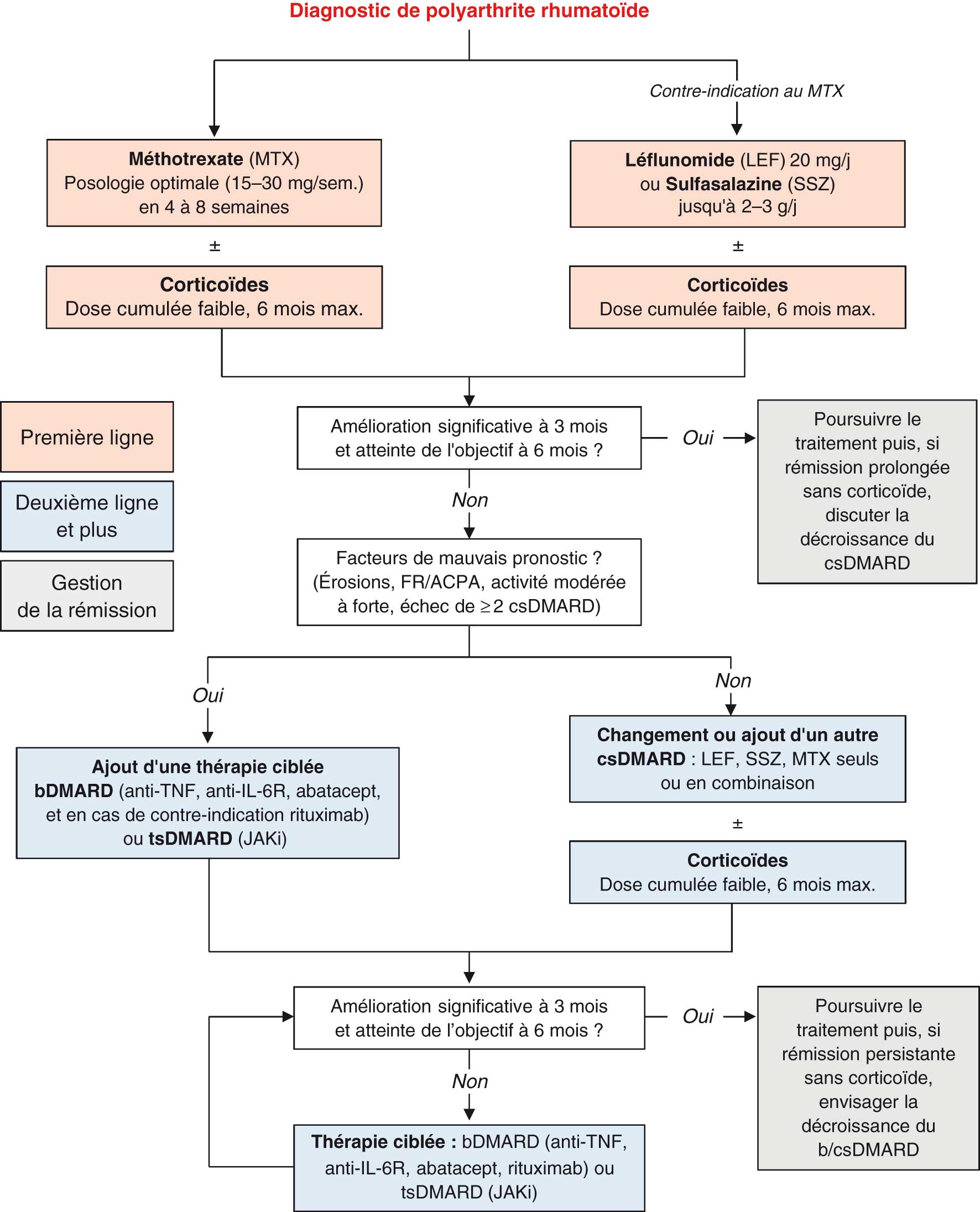
Il est recommandé d'instaurer le plus précocement possible un traitement de fond ![]() chez un patient ayant une polyarthrite persistante depuis plus de 6 semaines et dont le diagnostic de PR a été confirmé par un rhumatologue (fig. 17.12).
chez un patient ayant une polyarthrite persistante depuis plus de 6 semaines et dont le diagnostic de PR a été confirmé par un rhumatologue (fig. 17.12).
Fig. 17-12 :![]() Algorithme de prise en charge de la PR selon les recommandations de 2018 de la Société française de rhumatologie.
Algorithme de prise en charge de la PR selon les recommandations de 2018 de la Société française de rhumatologie.
(Source : Daien C, Hua C, Gaujoux-Viala C, et al. Update of French Society for Rheumatology Recommendations for Managing Rheumatoid Arthritis. Joint Bone Spine 2019 ;86(2):135–50.)
En première intention, en l'absence de contre-indication et en tenant compte des mises en garde spéciales et précautions d'emploi, il est recommandé d'initier un traitement de fond par méthotrexate, qui est le csDMARD de référence dans la PR (encadré 17.3).
Encadré 17.3 Modalités d'instauration et de surveillance du méthotrexate dans la polyarthrite rhumatoïde
Examens et mesures de sécurité recommandés avant l'instauration ou la réintroduction du méthotrexate
Posologie et mode d'administration
Examens et mesures de sécurité recommandés pendant le traitement (au moins une fois par mois pendant les 6 premiers mois, puis tous les 2 à 3 mois)
![]() Le méthotrexate a démontré son efficacité sur le contrôle de l'activité de la maladie et sa capacité à réduire la progression des lésions structurales dans la PR. Il a été utilisé comme traitement de référence et combiné aux bDMARD ou aux JAKi dans le cadre du développement de ces agents thérapeutiques dans la PR. Il a démontré un impact positif sur la réduction de la surmortalité globale et cardiovasculaire des patients atteints de PR. Sa tolérance est relativement bonne. Son coût est modéré.
Le méthotrexate a démontré son efficacité sur le contrôle de l'activité de la maladie et sa capacité à réduire la progression des lésions structurales dans la PR. Il a été utilisé comme traitement de référence et combiné aux bDMARD ou aux JAKi dans le cadre du développement de ces agents thérapeutiques dans la PR. Il a démontré un impact positif sur la réduction de la surmortalité globale et cardiovasculaire des patients atteints de PR. Sa tolérance est relativement bonne. Son coût est modéré.
Le méthotrexate est habituellement initié par voie orale à dose optimale de l'ordre de 0,3 mg/kg par semaine, comprise entre 15 et 25 mg par semaine, adaptée au contexte clinique et à la tolérance au traitement. Cette dose optimale doit être atteinte en 4 à 8 semaines. Il existe des formes sous-cutanées habituellement proposées en cas d'insuffisance de réponse ou de symptômes d'intolérance digestive à la voie orale. Il est recommandé de prescrire une supplémentation en folates d'au moins 5 mg par semaine, à prendre 24 à 48 heures après le méthotrexate.
D'autres traitements de fond, ayant fait la preuve de leur efficacité sur le contrôle de l'activité de la maladie et la réduction de la progression des lésions structurales dans la PR, peuvent être proposés en alternative au méthotrexate, en cas de contre-indication, de précaution d'emploi ou d'intolérance précoce au méthotrexate (fig. 17.12) :
Le suivi du patient doit être fréquent (1 à 3 mois) tant que la maladie est active. S'il n'y a pas d'amélioration dans les 3 mois suivant le début du traitement de fond ou si l'objectif thérapeutique n'a pas été atteint à 6 mois, il faut réaliser un ajustement thérapeutique (initiation d'un traitement de fond de deuxième ligne en monothérapie ou combiné au méthotrexate, initiation ou ajustement d'une corticothérapie générale à faible dose, réalisation d'infiltrations intra-articulaires de glucocorticoïdes, ajustement du traitement symptomatique par AINS et/ou antalgiques).
Chez les patients insuffisamment répondeurs ou intolérants au méthotrexate (cf. fig. 17.12) :
Les bDMARD ayant l'autorisation de mise sur le marché (AMM) dès la deuxième ligne ou en lignes ultérieures sont les anti-TNF (adalimumab, certolizumab pégol, étanercept et ses biosimilaires, golimumab, infliximab et ses biosimilaires), les anti-IL-6R (sarilumab et tocilizumab) et le CTLA4-Ig (abatacept), alors que l'anti-CD20 (rituximab) et ses biosimilaires ont une AMM dès la deuxième ligne.
Les JAKi ayant l'AMM dès la deuxième ligne ou en lignes ultérieures sont des inhibiteurs sélectifs et réversibles de JAK1/JAK2 (baricitinib) ou JAK1/JAK3 (tofacitinib) ou JAK1 (upadacitinib, filgotinib).
Les bDMARD et les JAKi doivent préférentiellement être associés au méthotrexate et leur utilisation en monothérapie doit être réservée aux situations d'intolérance au méthotrexate ou lorsque la poursuite du traitement par méthotrexate est inadaptée (tableau 17.2).
Tableau 17.2 : ![]() Biomédicaments et inhibiteurs de Janus kinases indiqués dans la polyarthrite rhumatoïde en 2020.
Biomédicaments et inhibiteurs de Janus kinases indiqués dans la polyarthrite rhumatoïde en 2020.
| Voie d'administration | Posologie | MTX insuffisant ou intolérant |
Monothérapie | |
|---|---|---|---|---|
| Adalimumab | SC | 40 mg/2 semaines → 40 mg/semaine (monothérapie) |
Oui | Oui MTX intolérant ou inadapté |
| Certolizumab pégol | SC | 200 mg/2 semaines 400 mg/4 semaines |
Oui | Oui MTX intolérant ou inadapté |
| Étanercept | SC | 25 mg × 2 fois/semaine 50 mg × 1 fois/semaine |
Oui | Oui MTX intolérant ou inadapté |
| Golimumab | SC | 50 mg × 1 fois/mois → 100 mg × 1 fois/mois (≥ 100 kg) |
Oui | Non |
| Infliximab | IV | 3 mg/kg/8 semaines → 7,5 mg/kg/8 semaines |
Oui | Non |
| Abatacept | SC IV |
125 mg/semaine ~ 10 mg/kg/4 semaines |
Oui | Non |
| Rituximab | IV | 1 g × 2 (J1 + J15) | Non (IR ou IN ≥ 1 anti-TNF) |
Non |
| Tocilizumab | SC IV |
162 mg/semaine ~ 8 mg/kg/4 semaines |
Oui | Oui MTX intolérant ou inadapté |
| Sarilumab | SC | 200 mg/2 semaines → 150 mg/2 semaines |
Oui | Oui MTX intolérant ou inadapté |
| Baricitinib | Per os | 4 mg/j → 2 mg/j | Oui | Oui |
| Tofacitinib | Per os | 5 mg × 2 fois/j | Oui | Oui MTX intolérant ou inadapté |
| Upadacitinib | Per os | 15 mg/j | Oui | Oui MTX intolérant ou inadapté |
| Filgotinib | Per os | 200 mg/j | Oui | Oui |
Les bDMARD et les JAKi ont démontré une efficacité symptomatique et structurale chez des patients atteints de PR en réponse inadéquate (inefficacité et/ou intolérance) au méthotrexate (cf. tableau 17.2).
La Commission de la transparence conseille, dans ses avis de juin 2017 (baricitinib) et de septembre 2017 (tofacitinib) que les JAKi soient utilisés de préférence en troisième ligne (à savoir après l'échec d'un bDMARD) voire plus, au vu des inquiétudes en termes de tolérance notamment à long terme liées au nouveau mécanisme d'action et du recul plus important en termes d'efficacité et de tolérance des bDMARD. À l'instar des bDMARD, l'association des JAKi au méthotrexate doit être privilégiée et la monothérapie doit être réservée aux situations d'intolérance au méthotrexate ou lorsque la poursuite du traitement par méthotrexate est inadaptée (cf. tableau 17.2).
![]() Les AINS sont des traitements symptomatiques utiles par leurs effets anti-inflammatoire et antalgique : diminution des douleurs et des gonflements articulaires, pas d'impact significatif sur CRP (et VS), pas d'impact sur la progression des lésions radiographiques.
Les AINS sont des traitements symptomatiques utiles par leurs effets anti-inflammatoire et antalgique : diminution des douleurs et des gonflements articulaires, pas d'impact significatif sur CRP (et VS), pas d'impact sur la progression des lésions radiographiques.![]() La prescription d'un AINS chez un patient atteint de PR ne doit pas déroger aux règles de bon usage des AINS (cf. chapitre 29) :
La prescription d'un AINS chez un patient atteint de PR ne doit pas déroger aux règles de bon usage des AINS (cf. chapitre 29) :
![]() Dans l'attente de l'efficacité du traitement de fond, une corticothérapie à faible dose peut être proposée, sur une période de moins de 6 mois. Cette corticothérapie est habituellement prescrite par voie orale, en monoprise matinale, faisant appel à de la prednisone, de la prednisolone ou de la méthylprednisolone. La posologie initiale se situe habituellement autour de 10 mg par jour d'équivalent prednisone, avec une diminution aussi rapide que possible, jusqu'à l'obtention de la dose minimale efficace se situant autour de 5 mg par jour d'équivalent prednisone, en vue d'un sevrage dans les 3 à 6 mois, dès que la PR est contrôlée par le traitement de fond.
Dans l'attente de l'efficacité du traitement de fond, une corticothérapie à faible dose peut être proposée, sur une période de moins de 6 mois. Cette corticothérapie est habituellement prescrite par voie orale, en monoprise matinale, faisant appel à de la prednisone, de la prednisolone ou de la méthylprednisolone. La posologie initiale se situe habituellement autour de 10 mg par jour d'équivalent prednisone, avec une diminution aussi rapide que possible, jusqu'à l'obtention de la dose minimale efficace se situant autour de 5 mg par jour d'équivalent prednisone, en vue d'un sevrage dans les 3 à 6 mois, dès que la PR est contrôlée par le traitement de fond.![]() Une alternative à la corticothérapie orale quotidienne est représentée par l'administration ponctuelle d'une corticothérapie par voie injectable (méthylprednisolone 80 à 120 mg par voie intramusculaire ou intraveineuse ou hexacétonide de triamcinolone par voie intra-articulaire) qui a l'avantage d'éviter les difficultés de sevrage de la corticothérapie par voie orale. Plusieurs études ont mis en évidence un effet structural des corticoïdes dans la PR récente, avec une diminution de la progression des lésions radiographiques sur une durée de traitement de 1 à 2 ans, conférant à la corticothérapie orale à faible dose un impact sur la maladie allant au-delà de celui d'un traitement symptomatique.
Une alternative à la corticothérapie orale quotidienne est représentée par l'administration ponctuelle d'une corticothérapie par voie injectable (méthylprednisolone 80 à 120 mg par voie intramusculaire ou intraveineuse ou hexacétonide de triamcinolone par voie intra-articulaire) qui a l'avantage d'éviter les difficultés de sevrage de la corticothérapie par voie orale. Plusieurs études ont mis en évidence un effet structural des corticoïdes dans la PR récente, avec une diminution de la progression des lésions radiographiques sur une durée de traitement de 1 à 2 ans, conférant à la corticothérapie orale à faible dose un impact sur la maladie allant au-delà de celui d'un traitement symptomatique.
L'effet symptomatique et structural des glucocorticoïdes est contrebalancé par leurs risques, démontrés dès 5 mg par jour d'équivalent prednisone en cas de prescription continue prolongée, mais aussi pour des doses cumulées élevées en cas de prescription discontinue prolongée. Il s'agit notamment de l'augmentation des risques d'infections sévères, d'événements cardiovasculaires, de troubles métaboliques (diabète de type 2, dyslipidémie) et d'ostéoporose, sans oublier le risque d'insuffisance corticotrope en cas de stress ou lors du sevrage.
Dans tous les cas, la décision d'initier une corticothérapie générale nécessite l'évaluation individuelle de la balance bénéfice/risque chez chaque patient et la prévention des effets indésirables en particulier cardiovasculaires (dépistage et prise en charge des facteurs de risque cardiovasculaire traditionnels) et osseux (évaluation du risque fracturaire et traitement antiostéoporotique).![]() Les infiltrations intra-articulaires de corticoïdes constituent une alternative à l'initiation d'une corticothérapie par voie orale, tout en améliorant localement les symptômes de l'inflammation articulaire, avec moins d'effets secondaires à long terme au vu d'une plus faible dose cumulée. Les produits retard sont préférés, notamment l'hexacétonide de triamcinolone. Si la synovite récidive après une à trois infiltrations intra-articulaires de corticoïdes, on peut avoir recours à une synoviorthèse isotopique.
Les infiltrations intra-articulaires de corticoïdes constituent une alternative à l'initiation d'une corticothérapie par voie orale, tout en améliorant localement les symptômes de l'inflammation articulaire, avec moins d'effets secondaires à long terme au vu d'une plus faible dose cumulée. Les produits retard sont préférés, notamment l'hexacétonide de triamcinolone. Si la synovite récidive après une à trois infiltrations intra-articulaires de corticoïdes, on peut avoir recours à une synoviorthèse isotopique.
La réadaptation fonctionnelle fait partie intégrante du traitement de la PR, en complément du traitement médicamenteux. Les indications de la réadaptation fonctionnelle sont plus larges dans la PR établie que dans les formes débutantes de la maladie qui ont été transformées par les avancées thérapeutiques médicamenteuses.![]() Elle a pour objectifs de limiter ou de prévenir les déformations, d'entretenir et d'améliorer la trophicité musculaire, la mobilité articulaire et de lutter contre l'enraidissement. Elle contribue à l'équilibre psychologique du malade et facilite son insertion socioprofessionnelle. Elle est idéalement réalisée par des équipes de kinésithérapeutes, d'ergothérapeutes spécialisés. Elle comporte l'éducation du malade, la réalisation d'appareillages (orthèses de repos et de correction pour les mains, les genoux, les chevilles, orthèses plantaires) et la rééducation proprement dite.
Elle a pour objectifs de limiter ou de prévenir les déformations, d'entretenir et d'améliorer la trophicité musculaire, la mobilité articulaire et de lutter contre l'enraidissement. Elle contribue à l'équilibre psychologique du malade et facilite son insertion socioprofessionnelle. Elle est idéalement réalisée par des équipes de kinésithérapeutes, d'ergothérapeutes spécialisés. Elle comporte l'éducation du malade, la réalisation d'appareillages (orthèses de repos et de correction pour les mains, les genoux, les chevilles, orthèses plantaires) et la rééducation proprement dite.
![]() La chirurgie fait elle aussi partie intégrante du traitement de la PR, en complément du traitement médicamenteux. Ses indications sont moins fréquentes à l'heure actuelle qu'elles ne l'étaient avant les avancées thérapeutiques médicamenteuses. Elles sont discutées avec le malade, idéalement dans le cadre de consultations médicochirurgicales réunissant le rhumatologue et le chirurgien orthopédiste. Il s'agit d'une chirurgie fonctionnelle visant à rétablir une fonction défaillante et à apporter l'indolence.
La chirurgie fait elle aussi partie intégrante du traitement de la PR, en complément du traitement médicamenteux. Ses indications sont moins fréquentes à l'heure actuelle qu'elles ne l'étaient avant les avancées thérapeutiques médicamenteuses. Elles sont discutées avec le malade, idéalement dans le cadre de consultations médicochirurgicales réunissant le rhumatologue et le chirurgien orthopédiste. Il s'agit d'une chirurgie fonctionnelle visant à rétablir une fonction défaillante et à apporter l'indolence.![]() La chirurgie de la PR obéit à certaines règles : donner la priorité aux membres inférieurs ; planifier les gestes chirurgicaux de l'extrémité vers la racine aux membres inférieurs et de la racine vers l'extrémité aux membres supérieurs ; commencer par une intervention « gagnante », à forte probabilité de bons résultats, chez un patient qui va justifier plusieurs interventions chirurgicales.
La chirurgie de la PR obéit à certaines règles : donner la priorité aux membres inférieurs ; planifier les gestes chirurgicaux de l'extrémité vers la racine aux membres inférieurs et de la racine vers l'extrémité aux membres supérieurs ; commencer par une intervention « gagnante », à forte probabilité de bons résultats, chez un patient qui va justifier plusieurs interventions chirurgicales.
Les synovectomies et les ténosynovectomies (poignets), les arthrodèses (poignets, arrière-pieds) et les arthroplasties prothétiques (épaules, coudes, hanches, genoux) sont les interventions chirurgicales les plus utilisées.
![]() Une prise en charge globale et multidisciplinaire doit être proposée au patient atteint de PR par le rhumatologue, intégrant outre les traitements médicamenteux, des thérapeutiques non médicamenteuses, adaptées individuellement à chaque patient, pouvant notamment inclure :
Une prise en charge globale et multidisciplinaire doit être proposée au patient atteint de PR par le rhumatologue, intégrant outre les traitements médicamenteux, des thérapeutiques non médicamenteuses, adaptées individuellement à chaque patient, pouvant notamment inclure :
![]() En cas de rémission persistante, sur une période d'au moins 6 mois, on peut envisager un allégement thérapeutique progressif.
En cas de rémission persistante, sur une période d'au moins 6 mois, on peut envisager un allégement thérapeutique progressif.
Avant toute modification des traitements de fond, la corticothérapie orale devra être progressivement arrêtée ou réduite à une dose minimale ≤ 5 mg par jour si l'arrêt complet s'avère impossible.
Toute décision de décroissance du bDMARD doit être prise dans le cadre d'une décision médicale partagée avec le patient. Une stratégie de décroissance du bDMARD (réduction de dose ou espacement des injections) est préférable à une tentative d'arrêt brutal, qui expose à un risque de reprise évolutive de la PR, pouvant s'accompagner d'une progression des lésions structurales.
En cas de rémission persistante à l'issue de la décroissance du bDMARD, une stratégie de décroissance du csDMARD (réduction de dose ou espacement des prises du méthotrexate) peut être envisagée, là encore dans le cadre d'une décision médicale partagée avec le patient.
![]() Au cours de la première année de la PR et jusqu'à l'atteinte de l'objectif de rémission ou de faible niveau d'activité de la maladie, on peut recommander une évaluation tous les 1 à 3 mois. Au-delà de la première année de la PR et lorsque l'objectif est atteint de façon persistante, on peut recommander une évaluation tous les 3 à 6 mois.
Au cours de la première année de la PR et jusqu'à l'atteinte de l'objectif de rémission ou de faible niveau d'activité de la maladie, on peut recommander une évaluation tous les 1 à 3 mois. Au-delà de la première année de la PR et lorsque l'objectif est atteint de façon persistante, on peut recommander une évaluation tous les 3 à 6 mois.
Le suivi clinique des patients doit comporter l'évaluation systématique :
![]() Le suivi biologique du patient contribue à l'évaluation de l'activité de la maladie, au dépistage ou au suivi de certains événements indésirables induits par les traitements de la PR, au dépistage ou au suivi de certaines manifestations extra-articulaires et de certaines comorbidités. Il comporte notamment des contrôles réguliers :
Le suivi biologique du patient contribue à l'évaluation de l'activité de la maladie, au dépistage ou au suivi de certains événements indésirables induits par les traitements de la PR, au dépistage ou au suivi de certaines manifestations extra-articulaires et de certaines comorbidités. Il comporte notamment des contrôles réguliers :
Le suivi radiographique du patient comporte des radiographies des mains, des pieds et des autres articulations inflammatoires, tous les 6 mois au cours de la première année, puis tous les ans au cours des trois premières années, la périodicité des contrôles étant ensuite adaptée en fonction de l'atteinte de l'objectif thérapeutique de rémission ou de faible niveau d'activité de la maladie et des dommages structuraux préexistants.
Légende :
Dans le respect de la Réforme du deuxième cycle des études médicales (R2C), les connaissances rassemblées sur ce site sont hiérarchisées en rang A, rang B et rang C à l'aide de balises et d'un code couleur :
![]() Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
![]() Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
![]() Connaissances spécifiques à un DES donné (troisième cycle).
Connaissances spécifiques à un DES donné (troisième cycle).
