Réaction inflammatoire : aspects biologiques et cliniques. Conduite à tenir
Item 185 UE VIII
1 - Définition et mécanismes physiopathologiques
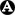 La réaction inflammatoire fait partie des mécanismes de défense de l'immunité naturelle.
La réaction inflammatoire fait partie des mécanismes de défense de l'immunité naturelle.
Cette dernière repose sur les barrières naturelles et la mise en place d'une réaction inflammatoire précoce face à toute agression, quelle qu'en soit la cause (physique, chimique, infectieuse, tumorale, etc.).
Cette réponse est immédiate, déclenchée par la libération de nombreux médiateurs issus de l'activation cellulaire, localisée et limitée dans le temps grâce à des mécanismes régulateurs et inhibiteurs, dominée par des modifications des parois vasculaires (endothélium, plaquettes, leucocytes).
Le but de cette réaction est de préparer l'organisme au stress, de le combattre, ainsi que de mettre en place les mécanismes de défense aigus et à plus long terme. Ces différents mécanismes peuvent être à l'origine de multiples pathologies du fait d'un défaut des systèmes effecteurs ou régulateurs.
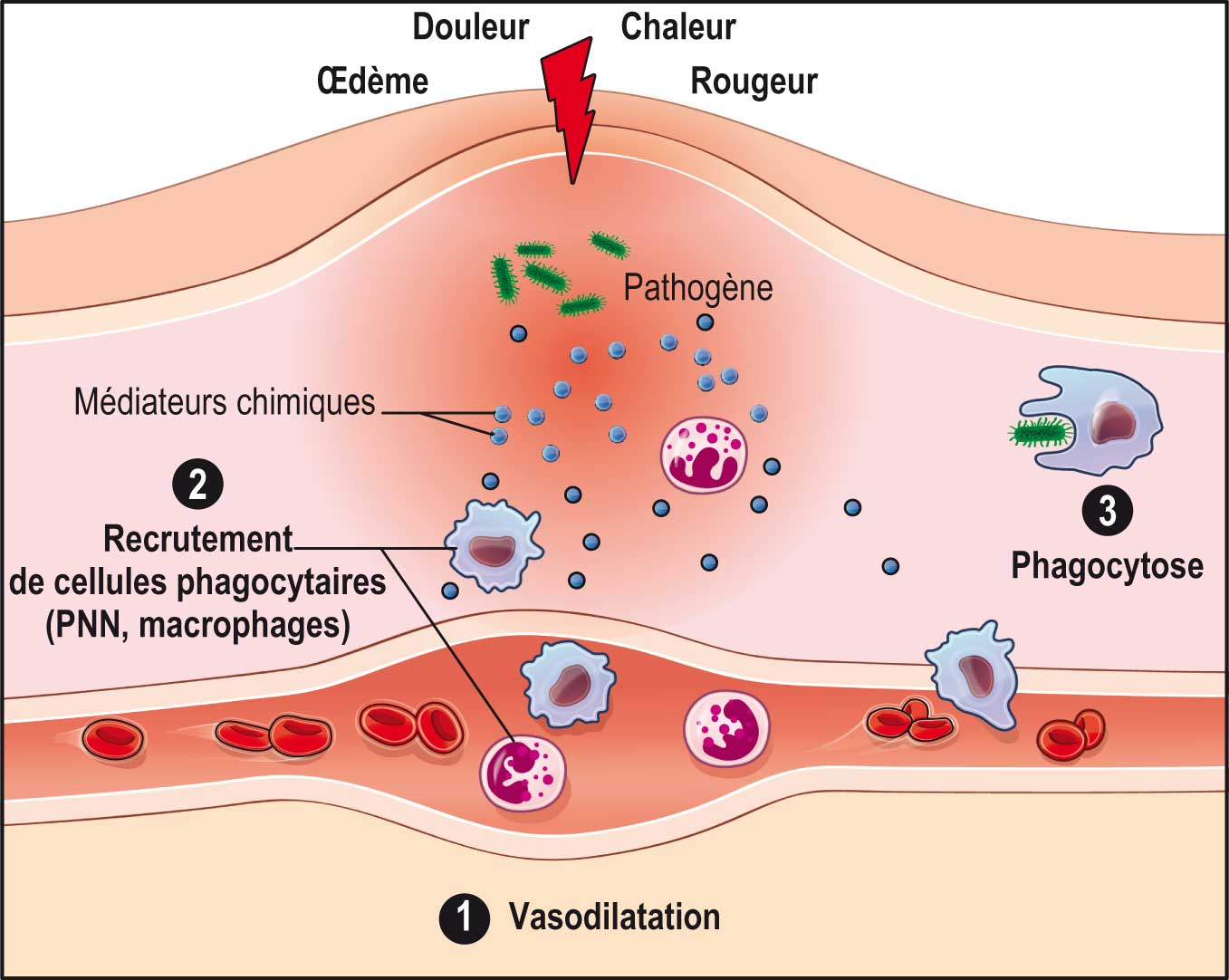
On peut arbitrairement définir trois phases au cours de la réaction inflammatoire : une phase d'initiation, une phase d'amplification et une phase de réparation.
 Plus précisément, on décrit (fig. 12.1) :
Plus précisément, on décrit (fig. 12.1) :
- une phase d'initiation (1), avec la libération de différentes substances de défense qui favorisent l'activation et le recrutement des cellules inflammatoires, augmentent la vasodilatation, l'expression des molécules d'adhérence et la perméabilité des capillaires et ont un effet nociceptif ;
- une phase d'amplification (2), avec :
- le recrutement rapide de cellules phagocytaires (polynucléaires neutrophiles entre autres) qui vont pénétrer le site inflammatoire et assurer la phagocytose des agents pathogènes, ainsi que des cellules infectées ou lésées ;
- puis l'activation secondaire des cellules macrophagiques qui vont à leur tour libérer des substances actives sur la phase vasculaire, participer à la phagocytose, initier la réponse immunitaire de type spécifique ;
- une phase de réparation (3), impliquant l'élimination des cellules lésées (phagocytose), la cicatrisation (fibrose, angiogenèse) et la régénération, sous le contrôle de cytokines anti-inflammatoires, de facteurs de croissance et de différenciation.
Fig. 12-1 : Réaction inflammatoire.
Réaction inflammatoire.
De nombreux médiateurs sont disponibles dans les granules des leucocytes et plaquettes et peuvent être rapidement libérés par les tissus endommagés ou stressés (médiateurs préformés tels qu'histamine, sérotonine, enzymes) ou sont produits par les différentes cellules du site inflammatoire (médiateurs néoformés tels que cytokines, chimiokines, prostaglandines). Ils comprennent :
- les amines vasoactives (histamine, sérotonine, bradykinine), qui favorisent l'afflux de cellules sur le site inflammatoire en induisant une vasodilatation et une augmentation de la perméabilité capillaire, et ont un effet nociceptif ;
- les médiateurs lipidiques dont la phospholipase A2, les cyclo-oxygénases (Cox-1 et Cox-2) et la lipo-oxygénase, qui induisent la synthèse de prostaglandines responsables de la vasodilatation, de l'augmentation de la perméabilité et des leucotriènes chimiotactiques ;
- les protéases (plasmine, trypsine, métalloprotéases, granzyme B), qui peuvent activer le système du complément, la fibrinolyse, favoriser la migration des cellules au sein de la matrice extracellulaire ;
- les protéines du complément dont les anaphylatoxines (C4a, C5a, C3a), qui induisent l'inflammation, le C3b qui effectue l'opsonisation, et les protéines du complexe d'attaque membranaire (C5b, C6 à C9) qui favorisent la destruction des pathogènes ou des cellules ;
- les protéines produites par le foie : la CRP, le sérum amyloïde A (SAA), l'α1-antitrypsine, l'haptoglobine, le fibrinogène et la céruléoplasmine ; elles ont un rôle d'opsonine et activent le complément ;
- les cytokines pro-inflammatoires, qui participent à la phase aiguë de l'immunité : TNFα, IL-1, IL-6, IL-17, IL-12, IL-23, qui sont essentiellement produites par les macrophages (TNFα, IL-1 principalement) et les lymphocytes Th17 (IL-17 principalement) ; non spécifiques, elles vont induire et réguler la réaction inflammatoire spécifique ;
- les cytokines anti-inflammatoires : IL-4, IL-10 et TGFβ, qui sont essentiellement produites par les lymphocytes (surtout lymphocytes T de type Th2) et vont jouer un rôle majeur dans la réaction inflammatoire lymphocytaire T ;
- des chimiokines, qui attirent sur le site inflammatoire d'autres cellules et régulent notamment l'angiogenèse et l'hématopoïèse ;
- des radicaux libres et le monoxyde d'azote (NO), qui auront des actions protectrices vis-à-vis de l'agent infectieux, mais parfois stressantes sur les cellules du site inflammatoire, en fonction de l'environnement et du type cellulaire.
2 - Signes cliniques et biologiques
 La réaction inflammatoire est un signe d'appel précieux qui constitue un élément majeur d'orientation diagnostique.
La réaction inflammatoire est un signe d'appel précieux qui constitue un élément majeur d'orientation diagnostique.
Elle peut être :
- aiguë (sepsis, traumatisme, défaillance multiviscérale, pancréatite aiguë…) ;
- ou chronique (rhumatismes inflammatoires, vascularites, cancers…) ;
- locale ;
- ou systémique.
2.1 - Signes cliniques
La pierre angulaire est la triade rougeur, chaleur et douleur :
- rougeur-chaleur-œdème : la libération des médiateurs vasoactifs entraîne la vasodilatation des capillaires et une augmentation de la perméabilité vasculaire qui sont responsables d'un œdème et d'un afflux local de leucocytes activés ;
- douleur : certains médiateurs comme la bradykinine libérés initialement lors de la réponse inflammatoire stimulent les voies nociceptives. La douleur elle-même, via la libération de neuropeptides, peut entretenir le processus inflammatoire et entraîner la libération de médiateurs vasoactifs ou chimiotactiques.
D'autres signes sont également liés au syndrome inflammatoire et aux cytokines pro-inflammatoires :
- fièvre : action des cytokines sur l'hypothalamus et le contrôle de la thermorégulation ;
- asthénie : action des cytokines sur l'hypothalamus ;
- anorexie ;
- amaigrissement : lié au syndrome inflammatoire chronique.
2.2 - Marqueurs biologiques
2.2.1 - Anomalies de l'hémogramme
Si l'inflammation est prolongée, elle entraîne des anomalies de l'hématopoïèse visibles sur l'hémogramme :
- anémie, d'abord normochrome normocytaire arégénérative, puis microcytaire, sans carence martiale ;
- hyperleucytose et thrombocytose.
2.2.2 - Dosage de la CRP, du fibrinogène et autres protéines
La CRP (C-Reactive Protein) s'élève très rapidement (6 à 12 heures), a une demi-vie courte (24 heures) et peut varier jusqu'à 1 000 fois la norme.
 Le fibrinogène, l'orosomucoïde et l'haptoglobine sont des protéines positives de l'inflammation avec des variations plus modérées (de 200 à 400 fois la norme), un délai de réponse (12 à 14 heures) et une demi-vie (2 à 6 jours) plus longs.
Le fibrinogène, l'orosomucoïde et l'haptoglobine sont des protéines positives de l'inflammation avec des variations plus modérées (de 200 à 400 fois la norme), un délai de réponse (12 à 14 heures) et une demi-vie (2 à 6 jours) plus longs.
2.2.3 - Vitesse de sédimentation
 L'inflammation se traduit par une augmentation de la vitesse de sédimentation (VS) globulaire, qui est une conséquence de l'augmentation des protéines de l'inflammation, notamment du fibrinogène, qui induisent des modifications de l'agrégation des hématies (hématies en rouleaux qui sédimentent plus vite). C'est un marqueur de cinétique lente (demi-vie 4 à 6 jours).
L'inflammation se traduit par une augmentation de la vitesse de sédimentation (VS) globulaire, qui est une conséquence de l'augmentation des protéines de l'inflammation, notamment du fibrinogène, qui induisent des modifications de l'agrégation des hématies (hématies en rouleaux qui sédimentent plus vite). C'est un marqueur de cinétique lente (demi-vie 4 à 6 jours).
La VS est mesurée par la hauteur en millimètres du coagulum obtenu à partir du sang, à la première heure (seule la mesure à la première heure est recommandée par le Comité international de standardisation en hématologie). Elle dépend du nombre, de la taille, de la charge des globules rouges, des protéines plasmatiques (protéines de l'inflammation, gammaglobulines), de l'âge et du sexe :
- âge en années divisé par 2 chez l'homme ;
- âge en années + 10 divisé par 2 chez la femme.
La VS est de moins en moins réalisée en pratique courante par certains centres en raison de sa cinétique et de sa mauvaise spécificité.
2.2.4 - Électrophorèse des protides sériques (EPP)
L'électrophorèse sérique permet d'étudier le profil des protéines sériques qui varie au cours de l'inflammation. Les protéines sont séparées en cinq fractions en fonction de leur poids moléculaire, du plus faible au plus élevé (fig. 12.2) :
- l'albumine (33 à 50 g/l) ;
- les α1-globulines (1,5 à 4 g/l) comprenant l'α1-antitrypsine, l'orosomucoïde et l'α1-antichymotrypsine ;
- les α2-globulines (6 à 10 g/l) comprenant l'α2-macroglobuline, l'haptoglobine et la céruléoplasmine ;
- les β-globulines (6 à 13 g/l) comprenant la transferrine, les lipoprotéines et le C3 du complément ;
- les γ-globulines (7,5 à 16 g/l) comprenant les immunoglobulines.
Fig. 12-2 :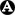 Électrophorèse des protides sériques normale.
Électrophorèse des protides sériques normale.
Les fractions α
1 et α
2 augmentent lors de l'inflammation mais elles peuvent rester normales même en cas d'inflammation persistante et élevée. L'albumine ainsi que la transferrine sont des protéines qui diminuent au cours d'un syndrome inflammatoire.
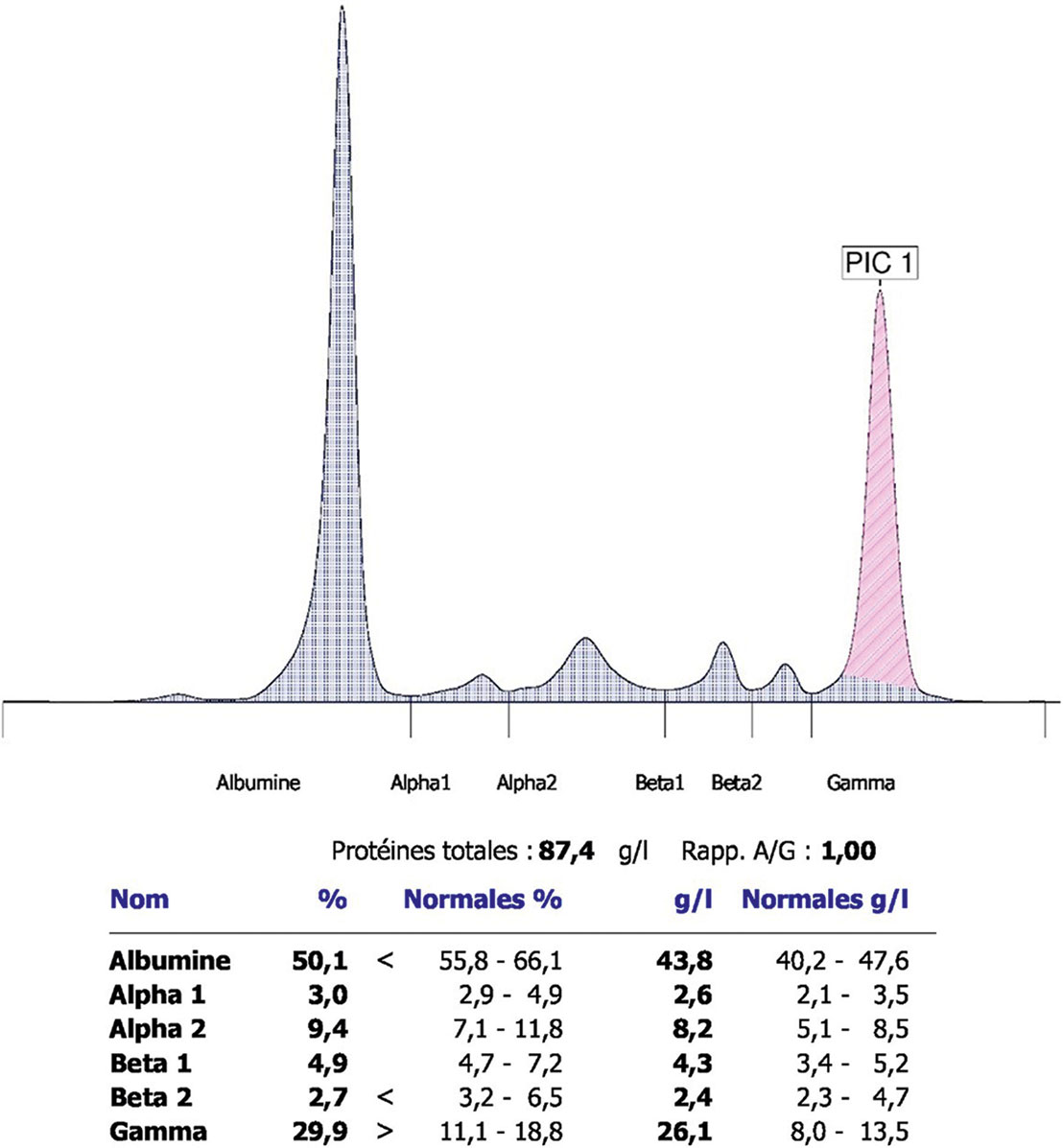
L'hypergammaglobulinémie polyclonale (fig. 12.3) témoigne d'un processus infectieux chronique, d'une maladie auto-immune ou d'une hépatopathie chronique. Si elle est monoclonale, elle doit faire rechercher un myélome (fig. 12.4).
Fig. 12-3 :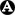 Électrophorèse des protides sériques révélant une hypergammaglobulinémie polyclonale.
Électrophorèse des protides sériques révélant une hypergammaglobulinémie polyclonale.
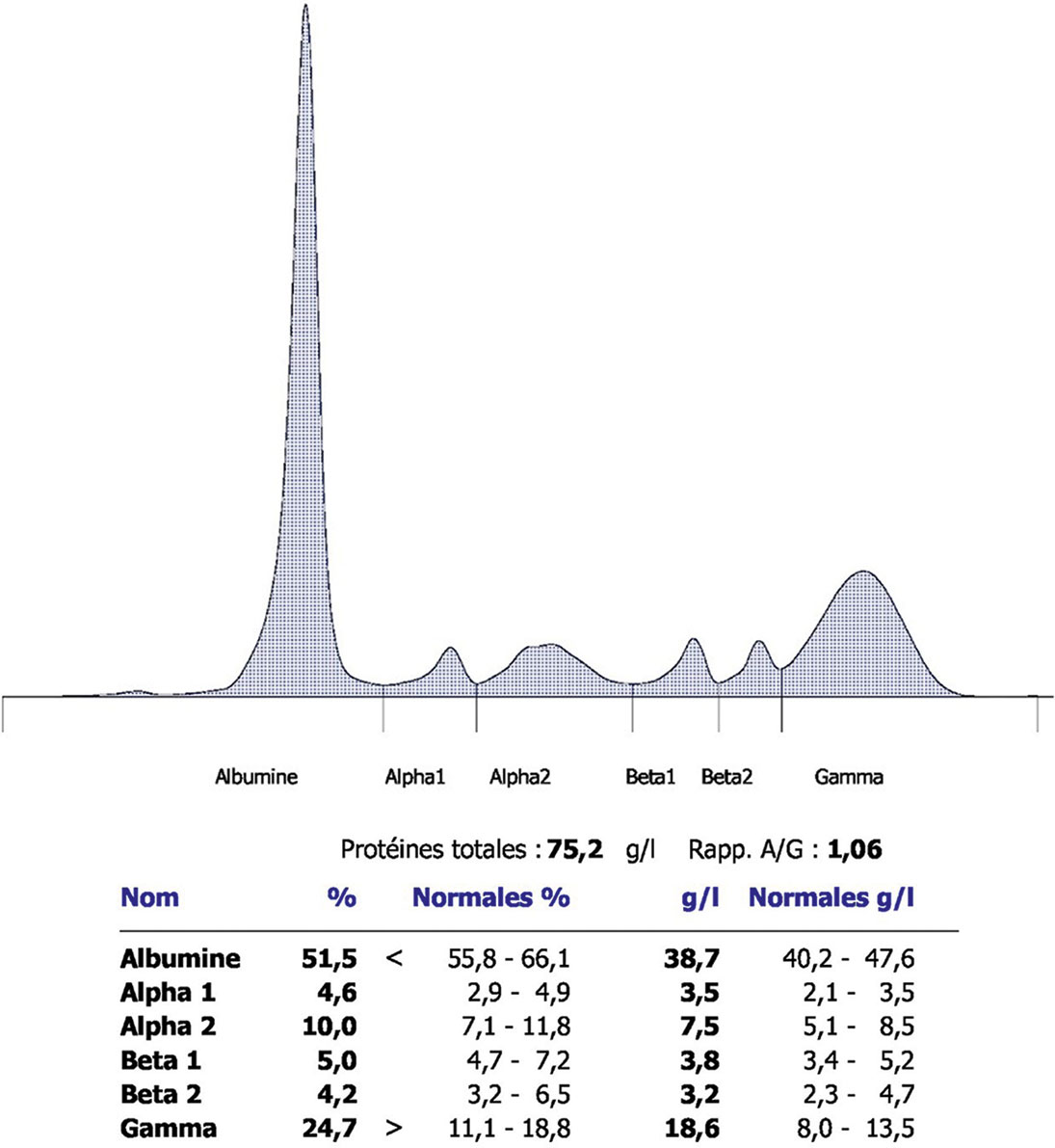
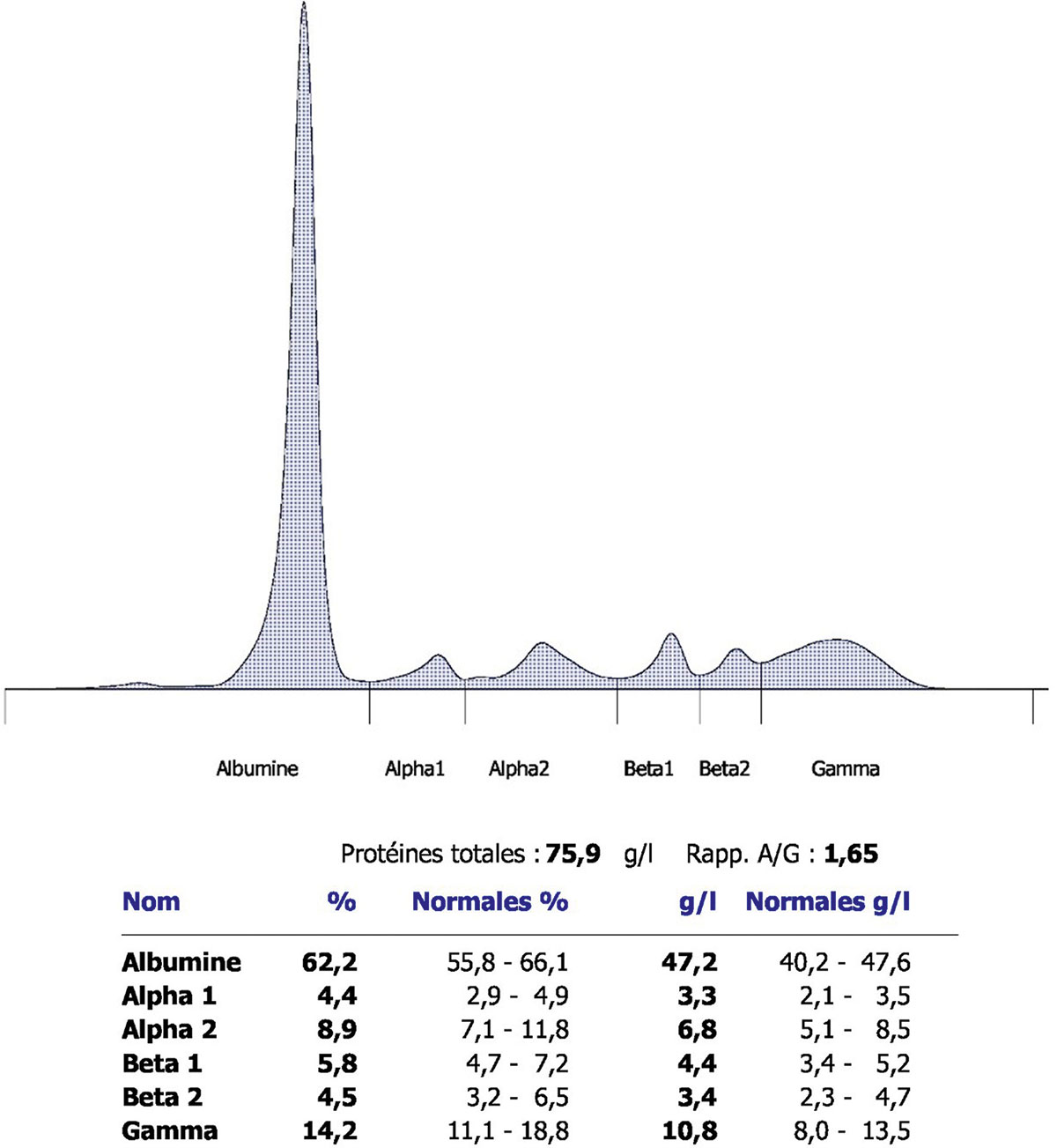
Fig. 12-4 :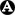 Électrophorèse des protides sériques révélant un pic monoclonal dans les gammaglobulines.
Électrophorèse des protides sériques révélant un pic monoclonal dans les gammaglobulines.
2.2.5 - Exploration du complément dans la réponse inflammatoire
 L'étude du complément se fait en routine dans le sérum et repose sur deux types de tests : les dosages immunochimiques, qui permettent de quantifier les différents composants du complément (C3, C4, B, C1-inhibiteur), et les tests fonctionnels reposant sur l'étude de la réaction d'hémolyse, qui permettent de mesurer l'activité hémolytique globale : complément hémolytique 50 (CH50). Le C3 et le C4 sont fréquemment élevés lors de la réponse inflammatoire. Le CH50 est diminué lors de la consommation de complément par activation de la voie classique (lupus, endocardite, glomérulonéphrite…) ou en cas de déficit génétique (C2, C1-inhibiteur).
L'étude du complément se fait en routine dans le sérum et repose sur deux types de tests : les dosages immunochimiques, qui permettent de quantifier les différents composants du complément (C3, C4, B, C1-inhibiteur), et les tests fonctionnels reposant sur l'étude de la réaction d'hémolyse, qui permettent de mesurer l'activité hémolytique globale : complément hémolytique 50 (CH50). Le C3 et le C4 sont fréquemment élevés lors de la réponse inflammatoire. Le CH50 est diminué lors de la consommation de complément par activation de la voie classique (lupus, endocardite, glomérulonéphrite…) ou en cas de déficit génétique (C2, C1-inhibiteur).
 En pratique courante, on réalise en première intention l'hémogramme et la CRP ± la VS (selon les centres). En deuxième intention on demande l'EPP.
En pratique courante, on réalise en première intention l'hémogramme et la CRP ± la VS (selon les centres). En deuxième intention on demande l'EPP.
3 - Conduite à tenir devant un syndrome inflammatoire
3.1 - Principales étiologies
- Origine infectieuse :
– 50 % des syndromes inflammatoires ;
– infection aiguë ;
– infection chronique évoluant à bas bruit (infection de prothèse ou valvulaire, infection ORL ou infection abdominale, tuberculose, parasitose, VIH, Whipple…). - Les cancers (hémopathies et lymphomes, cancers avec métastases, cancer du rein, cancer colique…) doivent être recherchés devant un syndrome inflammatoire chronique.
- Les maladies auto-immunes ou les rhumatismes inflammatoires, notamment pseudo-polyarthrite rhizomélique et artérite à cellules géantes, polyarthrite rhumatoïde, lupus, vascularite, maladie de Still, MICI, seront recherchés.
- Une maladie thromboembolique doit être évoquée.
-
 Les maladies auto-inflammatoires dues à une anomalie de l'immunité innée vont se manifester par des fièvres récurrentes inexpliquées, associées à des manifestations articulaires et cutanées (placard érysipéloïde), des sérites et des signes abdominaux. Il s'agit principalement de la fièvre méditerranéenne familiale (FMF) et du TRAPS (TNF Receptor-Associated Periodic Syndrome).
Les maladies auto-inflammatoires dues à une anomalie de l'immunité innée vont se manifester par des fièvres récurrentes inexpliquées, associées à des manifestations articulaires et cutanées (placard érysipéloïde), des sérites et des signes abdominaux. Il s'agit principalement de la fièvre méditerranéenne familiale (FMF) et du TRAPS (TNF Receptor-Associated Periodic Syndrome).
3.2 - Analyser les paramètres biologiques de l'inflammation pour en préciser les mécanismes et suivre son évolution
 En pratique clinique, les paramètres biologiques de l'inflammation sont utiles au diagnostic et au suivi évolutif de certaines affections inflammatoires (activité de la maladie, efficacité des traitements).
En pratique clinique, les paramètres biologiques de l'inflammation sont utiles au diagnostic et au suivi évolutif de certaines affections inflammatoires (activité de la maladie, efficacité des traitements).
Au cours des pathologies rhumatologiques, la présence d'un syndrome inflammatoire biologique sera un argument en faveur d'une étiologie non mécanique (affection inflammatoire, infectieuse ou tumorale). L'absence de syndrome inflammatoire ne permet certainement pas d'exclure un rhumatisme inflammatoire, une pathologie tumorale, voire une infection torpide ou décapitée.
En cas d'infection aiguë, un paramètre de cinétique rapide permettra de suivre au mieux l'évolution. Devant une pathologie inflammatoire chronique, certains préfèrent utiliser un paramètre traduisant l'état inflammatoire des jours précédents (VS).
Aucun des paramètres inflammatoires n'étant totalement spécifique de l'inflammation, il peut être utile dans une démarche diagnostique d'en mesurer deux, voire trois. Par exemple, l'haptoglobine est diminuée en cas d'hémolyse ; on retrouve une hypocomplémentémie dans certaines pathologies (lupus, cryoglobulinémie, endocardite, glomérulonéphrite).
 On entend par syndrome inflammatoire « dissocié » un tableau où deux paramètres de l'inflammation ont été mesurés avec des résultats discordants, l'une des mesures étant normale, l'autre anormale :
On entend par syndrome inflammatoire « dissocié » un tableau où deux paramètres de l'inflammation ont été mesurés avec des résultats discordants, l'une des mesures étant normale, l'autre anormale :
- un paramètre peut être anormal pour une tout autre raison qu'un syndrome inflammatoire ; par exemple, les causes non inflammatoires d'élévation de la VS : hypergammaglobulinémies polyclonales, monoclonales bénignes ou malignes, anémie, hémodilution (grossesse, insuffisance cardiaque, etc.), macrocytose, hypercholestérolémie, diabète. Une élévation de la VS sans élévation des protéines de l'inflammation doit donc faire réaliser un hémogramme, un ionogramme et une électrophorèse des protéines sériques ;
- à l'inverse, la dissociation peut être due à la fausse normalité d'un des paramètres, malgré la présence d'une véritable inflammation. Les principales causes de fausse normalité de la VS sont l'augmentation du culot globulaire (polyglobulie), l'hémoconcentration, la cryoglobulinémie, la diminution de taille (microcytose) ou de forme (acanthocytose) des globules rouges, l'hypofibrinogénémie congénitale ou acquise.
Outre la dissociation de la VS, on retiendra :
- dissociation albumine/transferrine, toutes deux protéines négatives de l'inflammation, évoquant une carence martiale par augmentation de la transferrine ;
- dissociation orosomucoïde/haptoglobine, toutes deux protéines positives de l'inflammation, évoquant une hémolyse par diminution de l'haptoglobine ;
- hypergammaglobulinémie à IgG, CRP normale, baisse du C3 ou du C4, baisse de l'haptoglobine par hémolyse, dans le lupus.
Enfin, on se rappellera que les cinétiques des marqueurs biologiques de l'inflammation sont différentes, ce qui peut expliquer certaines discordances en tout début ou à la fin d'une réaction inflammatoire.
3.3 - Complications d'un syndrome inflammatoire prolongé
- Dénutrition et cachexie : l'inflammation chronique associée, par exemple, aux cancers ou aux rhumatismes inflammatoires chroniques s'accompagne d'une perte de poids en rapport avec l'anorexie, la fatigue, une balance protéique négative responsable d'une perte de masse musculaire. Elles s'associent à une augmentation de la morbi-mortalité et du handicap (infections et immunosuppression, risque cutané, chutes, fractures).
- Ostéoporose : l'inflammation chronique peut provoquer une perte osseuse en rapport avec une augmentation de la résorption.
- Risque cardiovasculaire et troubles métaboliques : l'inflammation chronique est responsable d'une athérosclérose accélérée, d'une insulinorésistance et d'un risque de thrombose accru, ce qui augmente le risque d'événements et la mortalité cardiovasculaires (infarctus du myocarde ou AVC, risque thromboembolique).
-
 Amylose secondaire AA : elle peut compliquer un syndrome inflammatoire chronique, en particulier au cours de la polyarthrite rhumatoïde, de la maladie de Still, des maladies auto-inflammatoires. Elle est due à des dépôts extracellulaires anormaux composés de protéine AA qui dérive du clivage de la protéine SAA sécrétée en cas de syndrome inflammatoire. Elle est le plus souvent révélée par une atteinte rénale (protéinurie) ou cardiaque, plus rarement digestive. Le diagnostic est histologique (biopsie de graisse abdominale ou des glandes salivaires accessoires, biopsie d'organes).
Amylose secondaire AA : elle peut compliquer un syndrome inflammatoire chronique, en particulier au cours de la polyarthrite rhumatoïde, de la maladie de Still, des maladies auto-inflammatoires. Elle est due à des dépôts extracellulaires anormaux composés de protéine AA qui dérive du clivage de la protéine SAA sécrétée en cas de syndrome inflammatoire. Elle est le plus souvent révélée par une atteinte rénale (protéinurie) ou cardiaque, plus rarement digestive. Le diagnostic est histologique (biopsie de graisse abdominale ou des glandes salivaires accessoires, biopsie d'organes).
Légende :
Dans le respect de la Réforme du deuxième cycle des études médicales (R2C), les connaissances rassemblées sur ce site sont hiérarchisées en rang A, rang B et rang C à l'aide de balises et d'un code couleur :
 Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
 Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
 Connaissances spécifiques à un DES donné (troisième cycle).
Connaissances spécifiques à un DES donné (troisième cycle).
![]() La réaction inflammatoire fait partie des mécanismes de défense de l'immunité naturelle.
La réaction inflammatoire fait partie des mécanismes de défense de l'immunité naturelle.![]() Plus précisément, on décrit (fig. 12.1) :
Plus précisément, on décrit (fig. 12.1) :![]() Réaction inflammatoire.
Réaction inflammatoire.
![]() La réaction inflammatoire est un signe d'appel précieux qui constitue un élément majeur d'orientation diagnostique.
La réaction inflammatoire est un signe d'appel précieux qui constitue un élément majeur d'orientation diagnostique.![]() Le fibrinogène, l'orosomucoïde et l'haptoglobine sont des protéines positives de l'inflammation avec des variations plus modérées (de 200 à 400 fois la norme), un délai de réponse (12 à 14 heures) et une demi-vie (2 à 6 jours) plus longs.
Le fibrinogène, l'orosomucoïde et l'haptoglobine sont des protéines positives de l'inflammation avec des variations plus modérées (de 200 à 400 fois la norme), un délai de réponse (12 à 14 heures) et une demi-vie (2 à 6 jours) plus longs.![]() L'inflammation se traduit par une augmentation de la vitesse de sédimentation (VS) globulaire, qui est une conséquence de l'augmentation des protéines de l'inflammation, notamment du fibrinogène, qui induisent des modifications de l'agrégation des hématies (hématies en rouleaux qui sédimentent plus vite). C'est un marqueur de cinétique lente (demi-vie 4 à 6 jours).
L'inflammation se traduit par une augmentation de la vitesse de sédimentation (VS) globulaire, qui est une conséquence de l'augmentation des protéines de l'inflammation, notamment du fibrinogène, qui induisent des modifications de l'agrégation des hématies (hématies en rouleaux qui sédimentent plus vite). C'est un marqueur de cinétique lente (demi-vie 4 à 6 jours).![]() Électrophorèse des protides sériques normale.
Électrophorèse des protides sériques normale.
![]() Électrophorèse des protides sériques révélant une hypergammaglobulinémie polyclonale.
Électrophorèse des protides sériques révélant une hypergammaglobulinémie polyclonale.
![]() Électrophorèse des protides sériques révélant un pic monoclonal dans les gammaglobulines.
Électrophorèse des protides sériques révélant un pic monoclonal dans les gammaglobulines.
![]() L'étude du complément se fait en routine dans le sérum et repose sur deux types de tests : les dosages immunochimiques, qui permettent de quantifier les différents composants du complément (C3, C4, B, C1-inhibiteur), et les tests fonctionnels reposant sur l'étude de la réaction d'hémolyse, qui permettent de mesurer l'activité hémolytique globale : complément hémolytique 50 (CH50). Le C3 et le C4 sont fréquemment élevés lors de la réponse inflammatoire. Le CH50 est diminué lors de la consommation de complément par activation de la voie classique (lupus, endocardite, glomérulonéphrite…) ou en cas de déficit génétique (C2, C1-inhibiteur).
L'étude du complément se fait en routine dans le sérum et repose sur deux types de tests : les dosages immunochimiques, qui permettent de quantifier les différents composants du complément (C3, C4, B, C1-inhibiteur), et les tests fonctionnels reposant sur l'étude de la réaction d'hémolyse, qui permettent de mesurer l'activité hémolytique globale : complément hémolytique 50 (CH50). Le C3 et le C4 sont fréquemment élevés lors de la réponse inflammatoire. Le CH50 est diminué lors de la consommation de complément par activation de la voie classique (lupus, endocardite, glomérulonéphrite…) ou en cas de déficit génétique (C2, C1-inhibiteur).![]() En pratique courante, on réalise en première intention l'hémogramme et la CRP ± la VS (selon les centres). En deuxième intention on demande l'EPP.
En pratique courante, on réalise en première intention l'hémogramme et la CRP ± la VS (selon les centres). En deuxième intention on demande l'EPP.![]() En pratique clinique, les paramètres biologiques de l'inflammation sont utiles au diagnostic et au suivi évolutif de certaines affections inflammatoires (activité de la maladie, efficacité des traitements).
En pratique clinique, les paramètres biologiques de l'inflammation sont utiles au diagnostic et au suivi évolutif de certaines affections inflammatoires (activité de la maladie, efficacité des traitements).![]() On entend par syndrome inflammatoire « dissocié » un tableau où deux paramètres de l'inflammation ont été mesurés avec des résultats discordants, l'une des mesures étant normale, l'autre anormale :
On entend par syndrome inflammatoire « dissocié » un tableau où deux paramètres de l'inflammation ont été mesurés avec des résultats discordants, l'une des mesures étant normale, l'autre anormale :![]() Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.
Connaissances fondamentales que tout étudiant doit connaître en fin de deuxième cycle.![]() Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.
Connaissances essentielles à la pratique mais relevant d'un savoir plus spécialisé que tout interne d'une spécialité doit connaître au premier jour de son DES.![]() Connaissances spécifiques à un DES donné (troisième cycle).
Connaissances spécifiques à un DES donné (troisième cycle).